
【题目】在某密闭容器中,发生如下反应:2NO(g)+O2(g)![]() 2NO2(g) △H<0 。下列研究目的和示意图相符的是( )
2NO2(g) △H<0 。下列研究目的和示意图相符的是( )
A.平衡体系增加O2对反应的影响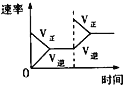
B.温度对反应的影响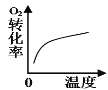
C.压强对反应的影(P1>P2)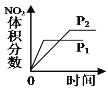
D.催化剂对反应的影响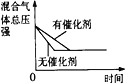
【答案】A
【解析】
A. 增大O2的量,平衡正向移动;
B. 该反应为放热反应,升高温度,平衡向放热的方向移动;
C. 增大压强,平衡向体积缩小的方向移动;
D. 加入催化剂,反应速率加快,平衡不移动。
A. 增大O2的量,平衡正向移动,图象正确,A项正确;
B. 该反应为放热反应,升高温度,平衡逆向移动,O2的转化率降低,曲线与研究目的不相符,B项错误;
C. 增大压强,反应速率加快,达到平衡所用的时间缩短,平衡正向移动,NO2的体积分数逐渐增大,曲线与研究目的不相符,C项错误;
D. 加入催化剂,反应速率加快,达到平衡所用的时间缩短,平衡不移动,曲线与研究目的不相符,D项错误;
答案选A。
改变的条件(其他条件不变) | 化学平衡移动的方向 | |||
浓度 | 增大反应物浓度或减小生成物浓度 | 向正反应方向移动 | ||
减小反应物浓度或增大生成物浓度 | 向逆反应方向移动 | |||
压强(对有气体参加的反应) | 反应前后气体体积改变 | 增大压强 | 向气体分子总数减小的方向移动 | |
减小压强 | 向气体分子总数增大的方向移动 | |||
反应前后气体体积不变 | 改变压强 | 平衡不移动 | ||
温度 | 升高温度 | 向吸热反应方向移动 | ||
降低温度 | 向放热反应方向移动 | |||
催化剂 | 同等程度改变v正、v逆,平衡不移动 | |||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]3H2O(三草酸合铁酸钾晶体)为翠绿色晶体,可用于摄影和蓝色印刷,110℃失去结晶水,230℃分解。某化学研究小组对K3[Fe(C2O4)3]3H2O受热分解生成的气体产物和固体产物进行探究。
实验一:探究实验所得的气体产物,按如图装置进行实验(夹持仪器已略去,部分装置可重复使用)。
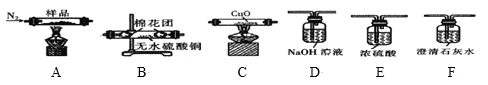
(1)实验室常用饱和NH4Cl和饱和NaNO2的混合液制N2,反应的化学方程式为__。
(2)装置的连接顺序为:A→__→__→__→__→__→F(填各装置的字母代号)。__
(3)检查装置气密性后,先通一段时间N2,其目的是__,实验结束时熄灭A、C两处的酒精灯,继续通N2至常温,其目的是__。
(4)实验过程中观察到F中的溶液变浑浊,C中有红色固体生成,则气体产物__(填化学式)。
实验二:分解产物中固体成分的探究
(5)定性实验:经检验,固体成分含有K2CO3、FeO、Fe。
定量实验:将固体产物加水溶解、过滤洗涤、干燥,得到含铁样品。完成上述实验操作,需要用到下列仪器中的___(填仪器编号)。

设计下列三种实验方案分别对该含铁样品进行含量的测定
甲方案:ag样品![]() 溶液
溶液![]() 得固体bg
得固体bg
乙方案:ag样品![]() 测得气体体积VmL(标况)
测得气体体积VmL(标况)
丙方案:ag样品![]() 250mL溶液
250mL溶液![]() 三次平均消耗0.1molL-1酸性KMnO4溶液VbmL
三次平均消耗0.1molL-1酸性KMnO4溶液VbmL
你认为以上方案中可以确定样品组成的有__方案。
(6)经测定产物中n(FeO):n(Fe)=1:1,写出K3[Fe(C2O4)3]3H2O分解的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示。下列有关叙述正确的是
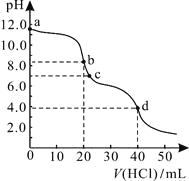
A. a点溶液呈碱性的原因用离子方程式表示为:CO![]() +2H2O
+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. c点处的溶液中c(Na+)-c(Cl-)=c(HCO![]() )+2c(CO
)+2c(CO![]() )
)
C. 滴定过程中使用甲基橙作为指示剂比酚酞更准确
D. d点处溶液中水电离出的c(H+)大于b点处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示原电池,盐桥中装有含琼胶的KCl饱和溶液,相关的叙述中,不正确的是( )
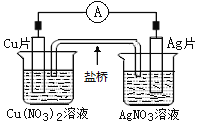
A.电子沿导线由Cu片流向Ag片
B.盐桥中的K+向Cu(NO3)2溶液
C.正极的电极反应是Ag++e-=Ag
D.Cu片上发生氧化反应,Ag片上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一氧化碳变换反应CO + H2O![]() CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
A.使用催化剂,活化分子百分数增大,有效碰撞几率增加
B.升高温度,活化分子百分数增大,有效碰撞几率增加
C.增大压强,单位体积内活化分子数增多,有效碰撞几率增加
D.增大c(CO),活化分子百分数增大,有效碰撞几率增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:AgSCN(白色,s)![]() Ag+(aq)+SCN-(aq),T℃时,Ksp(AgSCN)=1.0×10-12。在T℃时,向体积为20.00mL、浓度为mmol/L的AgNO3溶液中滴加0.l0mol/LKSCN溶液,溶液pAg的与加入的KSCN溶液体积的关系如图所示,下列说法错误的是( )
Ag+(aq)+SCN-(aq),T℃时,Ksp(AgSCN)=1.0×10-12。在T℃时,向体积为20.00mL、浓度为mmol/L的AgNO3溶液中滴加0.l0mol/LKSCN溶液,溶液pAg的与加入的KSCN溶液体积的关系如图所示,下列说法错误的是( )
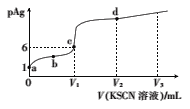
A.m=0.1
B.c点对应的KSCN溶液的体积为20.00mL
C.a、b、c、d点对应的溶液中水的电离程度:a>b>c>d
D.若V3=60mL,则反应后溶液的pAg=11-lg2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co2+的核外电子排布式为___,Co的第四电离能比Fe的第四电离能要小得多,原因是___。
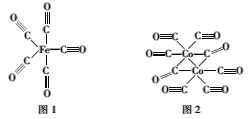
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1molFe(CO)5含有__mol配位键,图2中C原子的杂化方式为___,形成上述两种化合物的四种元素中电负性最大的是___(填元素符号)。
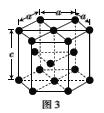
(3)金属钴的堆积方式为六方最密堆积,其配位数是___,钴晶体晶胞结构如图3所示,该晶胞中原子个数为___;该晶胞的边长为anm,高为cnm,该晶胞的密度为___(NA表示阿伏加德罗常数的值,列出代数式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用NaOH溶液来滴定邻苯二甲酸氢钾溶液有下列操作:
①向溶液中加入1~2滴指示剂
②取20.00 mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是_____________________________,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是______________。
(2)选用指示剂是______________,滴定终点现象______________________________________。
(3)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:
滴定次数实验数据 | 1 | 2 | 3 | 4 |
V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为V(NaOH)=(19.98+20.00+20.80+20.02)/4mL=20.20mL,他的计算合理吗?理由是_______________。
(4)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,滴定前用蒸馏水洗净碱式滴定管,然后加NaOH溶液进行滴定,此操作对实验结果________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()
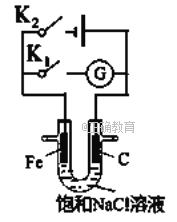
A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com