
| A. | 能使甲基橙变红的溶液:Mg2+、Na+、NO3-、Cl- | |
| B. | 0.1mol•L-1NH4Cl溶液:K+、Ba2+、OH-、CO32- | |
| C. | 0.1mol•L-1Fe(NO3)2溶液:H+、Al3+、SO42-、I- | |
| D. | 由水电离产生的c(H+)=10-12mol•L-1的溶液:NH4+、SO42-、HCO3-、Cl- |
分析 A.能使甲基橙变红的溶液呈酸性,四种离子之间不反应,都不与酸性溶液中的氢离子反应;
B.氯化铵与氢氧根离子反应,钡离子与碳酸根离子反应;
C.酸性条件下硝酸根离子具有强氧化性,能够氧化亚铁离子、碘离子;
D.由水电离产生的c(H+)=10-12mol•L-1的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子与氢离子、氢氧根离子反应.
解答 解:A.能使甲基橙变红的溶液中存在大量氢离子,Mg2+、Na+、NO3-、Cl-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故A正确;
B.Ba2+、CO32-之间反应生成碳酸钡沉淀,OH-、NH4Cl之间发生反应,在溶液中不能大量共存,故B错误;
C.Fe(NO3)2在溶液中电离出亚铁离子和硝酸根离子,硝酸根离子在酸性条件下能够氧化Fe2+、I-,在溶液不能大量共存,故C错误;
D.由水电离产生的c(H+)=10-12mol•L-1的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,HCO3-与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
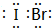 ,它是由σ键形成的(根据原子轨道的重叠程度填写).
,它是由σ键形成的(根据原子轨道的重叠程度填写).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
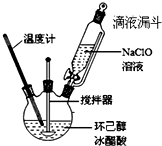 环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.
环己酮是重要的化工原料,也是重要的工业溶剂,实验室常用次氯酸氧化法制备环己酮.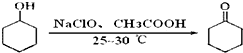
| 物质 | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环己醇 | 26 | 160.8 | 可溶于水 |
| 环己酮 | -45 | 155.6 | 微溶于水 |
| 冰醋酸 | 16.6 | 117.9 | 可溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应达到平衡状态后,各物质浓度不变,反应停止 | |
| B. | 反应达到平衡状态后,单位时间内生成1molN2的同时消耗3molH2 | |
| C. | 在上述条件下,N2不可能100%转化为NH3 | |
| D. | 使用催化剂是为了加快反应速率,提高生产效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
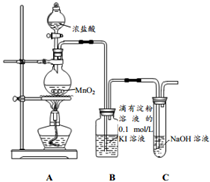 探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)
探究氯气与KI溶液的反应,某课外小组用如图装置进行实验(夹持仪器已略去,气密性已检验)| 实验操作 | 实验现象 |
| 打开A中分液漏斗活塞,放下部分浓盐酸,加热 | 装置B中溶液变蓝色,随后蓝色褪去,溶液显浅棕色 |
| 实验操作 | 实验现象 |
| Ⅰ.取反应后B中的溶液4mL分成两等份,第一份滴入1滴碘水;第二份滴入淀粉溶液 | 第一份溶液蓝色 第二份溶液颜色没有变化 |
| Ⅱ.将I2溶于KI溶液中配制得碘总浓度为0.1mol/L的溶液,取上述溶液2mL,滴加1滴淀粉溶液,再通入氯气 | 加淀粉后溶液变蓝,通氯气后蓝色褪去,溶液显浅棕色 |
| Ⅲ.向Ⅱ所得溶液继续通入氯气 | 溶液几乎变为无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol过氧化钠和足量水充分反应,理论上转移的电子数约为2×6.02×1023 | |
| B. | 电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)<Ksp(MnS) | |
| D. | 0.1mol•L-1醋酸溶液pH=a,0.01mol•L-1醋酸溶液pH=b,则a+1<b |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNH4Cl固体中共价键总数为5NA | |
| B. | 16gO2与O3的混合物中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入3molH2和1molN2,充分反应后得2NA个氨分子 | |
| D. | 18g水(H2O)含有8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C2H5OH | D. | CH3CHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com