
| A.①④ | B.②③ | C.①③ | D.②④ |
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.上述焙烧过程的尾气均可直接排空 |
| B.由6 mol CuFeS2生成6 mol Cu,上述共消耗15 mol O2 |
| C.在反应2Cu2O+Cu2S=6Cu+SO2↑中,作氧化剂的只有Cu2O |
| D.电解精炼时,粗铜应与外电源负极相连 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 5CO2(g)+I2(s);ΔH 1
5CO2(g)+I2(s);ΔH 1 2CO2(g);ΔH 2
2CO2(g);ΔH 2 2I2O5(s);ΔH 3
2I2O5(s);ΔH 3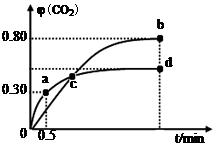
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的平均相对分子质量相等 |
| C.增加I2O5的投料量有利于提高CO的转化率 |
| D.b点和d点的化学平衡常数:Kb<Kd |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
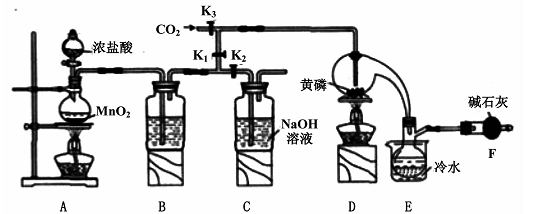

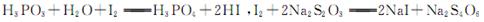 已知: ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为 。
已知: ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.与NaOH反应的氯气一定为0.3 mol |
| B.n(Na+)∶n(Cl-)可能为7∶3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K2Cr2O7可以氧化乙醇,可用来鉴别司机是否酒后驾驶 |
| B.污水中铬一般以Cr3+存在,与水中的溶解氧作用可被还原为六价铬 |
| C.人体内六价铬超标,服用维生素C缓解毒性,说明维生素C具有还原性 |
| D.1 mol Cr2O72—得到6 mol电子时,还原产物是Cr3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

 C对应的化学方程式 。
C对应的化学方程式 。| A.滴定管在盛装高锰酸钾前未润洗 |
| B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出 |
| C.滴定前读数正确,滴定终点时俯视读数 |
| D.滴定前读数正确,滴定终点时仰视读数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com