
【题目】下列关于铝的叙述中,不正确的是( )
A.铝是地壳里含量最多的金属元素B.铝是一种比较活泼的金属
C.在常温下,铝不能与氧气反应D.在化学反应中,铝易失去电子,是还原剂
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)稀酸A的分子式是_____________________________________________。
(2)滤液1中加入H2O2溶液的目的是___________________________________________。
(3)设计实验证明滤液1中含有Fe2+___________________________________________。
(4)在酸性溶液中,已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________________________________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式_____________________________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是__________________________________________。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000 mol·L-1的FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为______________ (结果保留两位有效数字),Mr(Ce)=140。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。则下列说法正确的是( )

A. X与A反应的化学方程式是:Al2O3 + 2Fe ![]() Fe2O3 + 2Al
Fe2O3 + 2Al
B. 检验D溶液中的金属阳离子的反应:Fe3++3SCN—= Fe(SCN)3↓
C. 单质Y在一定条件下能与水发生置换反应
D. 由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 124g P4含有的P-P键的个数为6NA
B. 12g石墨中含有的C-C键的个数为2NA
C. 12g金刚石中含有的C-C键的个数为1.5NA
D. 60gSiO2中含Si-O键的个数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做苯酚的性质实验时,将少量溴水滴入苯酚溶液中,结果没有发生沉淀现象,他又继续在反应混合液中滴入足量的氢氧化钠溶液,此时他发现 ( )
A. 溶液中仍无沉淀
B. 溶液中产生白色沉淀
C. 先产生沉淀后沉淀溶解
D. 溶液呈橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其制备途径及性质如图所示。下列说法不正确的是
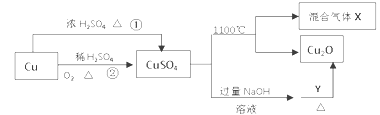
A. 相对于途径①,途径②更好地体现了绿色化学思想
B. Y在反应中起到还原剂的作用
C. 将CuSO4溶液蒸发浓缩,冷却结晶可制得胆矾晶体
D. CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋经济已经成为拉动我国国民经济发展的重要引擎,海水的综合开发、利用是海洋经济的一部分,海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。其流程如下图所示:

(1)写出镁原子的结构示意图:_________________。在反应①→⑤中属于氧化还原反应的是___________(填序号);
(2)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、________溶液;③_________;④滤液中加适量盐酸;⑤__________(请补全缺少的实验步骤或试剂);
(3)某同学利用反应①原理制备氯气,将200 mL 5.0 mol·L-1NaCl溶液进行电解,则理论上最多可制得标准状况下氯气的体积为__________L;
(4)实验室模拟Mg的制取流程时,用11.3 mol·L-1的浓盐酸配置反应③所需要的0.5 mol·L―1稀盐酸100 mL,需要用量筒量取浓盐酸________mL,接下来的配制过程除了玻璃棒和烧杯外,还需要用到的玻璃仪器有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子反应方程式正确的是
A. 氯气溶于水:![]()
B. 碳酸氢钠和氢氧化钠溶液反应:HCO3-+OH-=CO32-+H2O
C. ![]() 溶液中加入
溶液中加入![]() 溶液:
溶液:![]()
D. 铁和稀硝酸反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应进行的方向和限度是化学反应原理所要研究的两个重要问题,下列有关化学反应进行的方向和限度的说法中正确的是( )
A. mA(g)+nB(g)![]() pC(g),平衡时A的浓度等于0.5mol/L,将容器体积扩大一倍,达到新的平衡后A的浓度变为0.3mol/L,则计量数m+n < p
pC(g),平衡时A的浓度等于0.5mol/L,将容器体积扩大一倍,达到新的平衡后A的浓度变为0.3mol/L,则计量数m+n < p
B. 对于反应A(g)+B(g)![]() 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变
2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变
C. 将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中,在恒定温度下使其达到分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判断的依据
2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判断的依据
D. 2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com