
【题目】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,下列有关表述错误的是

A.利用了电解原理
B.钢管桩上有刺激性气味气体生成
C.电子由电源负极流向钢管桩
D.高硅铸铁作阳极
【答案】B
【解析】
外加电流阴极保护是通过外加直流电源以及辅助阳极,被保护金属与电源的负极相连作为阴极,电子从电源负极流出,给被保护的金属补充大量的电子,使被保护金属整体处于电子过剩的状态,让被保护金属结构电位低于周围环境,从而使得金属腐蚀发生的电子迁移得到抑制,避免或减弱腐蚀的发生,阳极若是惰性电极,则是电解质溶液中的离子在阳极失电子。
A. 由于此保护装置有外加电源,构成了电解池,故利用了电解原理,A正确;
B. 钢管桩要被保护,应做阴极,阴极产生氢气,氢气为无色无味的气体,B错误;
C. 在电解池中,钢管桩要被保护,应做阴极,连接电源的负极,故电子由电源的负极流向钢管桩, C正确;
D. 高硅铸铁连接电源的正极,做电解池的阳极, D正确。
答案选B。


科目:高中化学 来源: 题型:
【题目】己烯雌酚(结构简式如图所示》,是一种激素类药物。下列叙述正确的是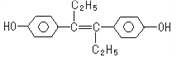
A. 己烯雌酚分子式为C18H12O2
B. 己烯雌酚与NaOH溶液、NaHCO3溶液均能反应
C. 1mol己烯雌酚最多能与4mol溴发生反应
D. 己烯雌酚可以发生加成反应,取代反应、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫代碳酸钠(Na2CS3)常用作杀菌剂、沉淀剂。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验1:探究Na2CS3的性质
步骤 | 操作及现象 |
① | 取少量Na2CS3 固体溶于蒸馏水配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试液,溶液变红色 |
③ | 向另一份溶液中滴加酸性KMnO4溶液,紫色褪去 |
(1)H2CS3是________酸(填“强”或“弱”)。
(2)已知步骤③的氧化产物是SO42-,写出该反应的离子方程式________________________。
实验2:测定Na2CS3溶液的浓度,按如图所示连接好装置,取100mLNa2CS3溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。

已知:Na2CS3 + H2SO4=Na2SO4 + CS2 + H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放无水CaCl2的仪器的名称是____________。
(4)反应结束后打开活塞k,再缓慢通入热N2一段时间,其目的是___________________。
(5)为了计算Na2CS3溶液的浓度,对B中混合物进行过滤、洗涤、干燥、称重,得19.2g固体,则A中Na2CS3的物质的量浓度为____________________。
(6)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为 ________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为 _____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为 ____________,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应aA(g)+bB(g)![]() cC(g)+dD(g) ΔH,反应特点与对应的图像的说法中不正确的是( )
cC(g)+dD(g) ΔH,反应特点与对应的图像的说法中不正确的是( )

A.图甲中,若p1>p2,则在较低温度下有利于该反应自发进行
B.图乙中,若T2>T1,则ΔH<0且a+b=c+d
C.图丙中,t1时刻改变的条件一定是使用了催化剂
D.图丁中,若ΔH<0,则纵坐标不可能表示的是反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究SO2和Cl2能否发生反应,设计如图所示的实验装置进行实验。
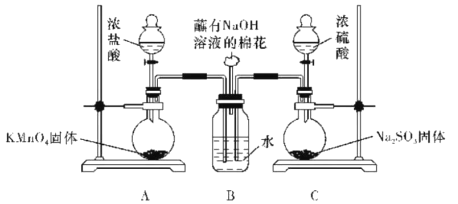
(1)装置A制取氯气,该反应的化学方程式:__。
(2)为验证SO2和Cl2发生了反应,小组同学又继续如下实验。
①甲同学认为若SO2和Cl2反应,生成了Cl-,只要检验到生成的Cl-即可,甲取适量B中样品于试管中,向其中滴加少量__溶液,有白色沉淀生成。
②乙同学认为甲同学的结论不合理,认为应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法实验即可得到正确结论。洗气瓶中盛有试剂的名称是___。
③丙同学认为按乙同学的建议改进实验也不合理,理由是__。
④丙同学取溶液X于试管中,加入少量反应后B中的溶液,生成大量白色沉淀,得出正确结论:SO2与Cl2同时通入水中,可以发生反应。溶液X是__。(填字母代号)
a.BaCl2溶液 b.Ba(OH)2溶液 c.氯水 d.石蕊溶液
SO2与Cl2同时通入水中反应的化学方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、300℃时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g)2Z(g)ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
(1)反应0~2minZ的平均速率v(Z)=____
(2)能判断该反应已经达到平衡状态的是____
A.生成X的速率是生成Z的速率的2倍 B.容器内压强保持不变
C.容器内气体的密度保持不变 D.容器内各气体的浓度保持不变
(3)温度为300℃时,该反应的化学平衡常数K= ___
II、(1)常温下,0.005mol·L-1Ba(OH)2溶液的pH=_____
(2)常温下,向0.1mol·L-1NH3·H2O溶液中不断加水,过程中c(OH-)/c(NH3·H2O)将____(选填“增大”、“减小”或“不变”)
(3)下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
Fe3+ | Al3+ | Zn2+ | |
开始沉淀的pH | 1.1 | 3.2 | 5.9 |
完全沉淀的pH | 3.2 | 5 | 8.9 |
某溶液中含Fe3+、Al3+、Zn2+,欲除去Fe3+、Al3+,向其中滴加1.0moL·L-1的NaOH溶液调节溶液的pH为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以两种烃为主要原料合成香料M的路线如下:
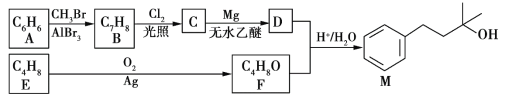
已知:①A分子只有一种氢原子。E能使酸性高锰酸钾溶液褪色,与HBr发生反应可得到2种产物。
②RX![]() R-MgX(X为卤原子)
R-MgX(X为卤原子) ![]() RCH2CH2OMgX
RCH2CH2OMgX![]() RCH2CH2OH
RCH2CH2OH
回答下列问题:
(1)C中官能团名称是__________________;E的名称是__________________。
(2)F的结构简式为__________________;B→C的反应类型是__________________。
(3)写出A→B的化学方程式:____________________________________。
(4)在F的单官能团同分异构体中,除环醚外,还有____________种。其中,在核磁共振氢谱上有3个峰且峰的面积比为1∶1∶6的结构简式为__________________。
(5)写出鉴别A、B两种有机物可选用的化学试剂__________________。
(6)以苯和环氧乙烷(![]() )为原料制备苯乙醇,设计不超过4步的合成路线_________________(无机试剂任选)。
)为原料制备苯乙醇,设计不超过4步的合成路线_________________(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com