
已知反应:
①SO3+H2O=H2SO4
②Cl2+H2O=HCl+HClO
③2F2+2H2O=4HF+O2↑
④2Na+2H2O=2NaOH+H2↑
⑤2Na2O2+2H2O=4NaOH+O2↑
⑥SiO2+2NaOH=Na2SiO3+H2O
(1)上述反应中不属于氧化还原反应的有________(填序号,下同).H2O被氧化的是________、H2O被还原的是________.属于氧化还原反应,但其中的H2O既不被氧化,又不被还原的是________.
(2)写出方程式②的离子方程式________.
(3)标出方程式④的电子转移的方向和数目________.
科目:高中化学 来源:物理教研室 题型:022
编号 起始状态/mol 平衡时n(NBr)/mol
H2 Br2 HBr HBr
已知 1 2 0 a
① 2 4 0
② 1 0.5a
③ m n(n³2m)
查看答案和解析>>
科目:高中化学 来源: 题型:022
在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+Br2(g)ƒ2HBr(g),已知加入1mol H2和2mol Br2时,达到平衡后生成amol HBr(见下表“已知”项),在相同条件下,仍保持平衡时各组分的体积分数不变,对下列编号①~③的状态,填写表中的空白。
编号 起始状态/mol 平衡时n(NBr)/mol
H2 Br2 HBr HBr
已知 1 2 0 a
① 2 4 0
② 1 0.5a
③ m n(n³2m)
查看答案和解析>>
科目:高中化学 来源: 题型:022
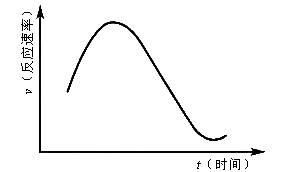
(1)KClO3与NaHSO3间的氧化还原反应生成Cl-和SO42-的速率与时间关系如图,已知反应速率随c(H+)的增加而加快,试说明
(1)为什么反应开始时,反应速率增大?________________。
(2)反应后期,反应速率逐渐降低的主要原因是________________。
(2)对于反应:2SO2+O2ƒ2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”、“减小”或“不变”)
编号 改变的条件 生成SO3的速率
① 升高温度
② 降低温度
③ 增大O2的浓度
④ 使用V2O3作催化剂
⑤ 压缩体积
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)已知醛在一定条件下可以发生如下转化:
![]()
![]()

![]()
![]()
 物质C是一种可以作为药物的芳香族化合物,请根据下图(所有无机产物均已略去)中有机物的转化关系回答下列问题:
物质C是一种可以作为药物的芳香族化合物,请根据下图(所有无机产物均已略去)中有机物的转化关系回答下列问题:
![]() (1)写出指定物质的结构简式:A ,
(1)写出指定物质的结构简式:A ,
![]() G 。
G 。
![]() (2)反应①的反应类型是 ,反应②的反应类型是 ,
(2)反应①的反应类型是 ,反应②的反应类型是 ,
![]() 反应⑧的反应类型是 。
反应⑧的反应类型是 。
![]() (3)写出C与新制Cu(OH)2共热生成D的化学方程式(有机物写结构简式):
(3)写出C与新制Cu(OH)2共热生成D的化学方程式(有机物写结构简式):
![]() 。
。
![]() 写出反应⑧的化学方程式(有机物写结构简式):
写出反应⑧的化学方程式(有机物写结构简式):
![]() 。
。
![]() (4)H有多种同分异构体,其中能与金属钠反应且苯环上只有一个取代基的H的同分异构体结构简式为:
(4)H有多种同分异构体,其中能与金属钠反应且苯环上只有一个取代基的H的同分异构体结构简式为:
![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性反应体系中,反应物和生成物共六种物质:PbO2、PbSO4 (难溶盐)、Pb(MnO4)2(高锰酸铅强电解质)、H2O、X(水溶液呈无色)、H2SO4,已知X是一种盐,且0.1molX在该反应中应失去3.01×1023个电子。下列说法中不正确的是( )
A、若有9.8gH2SO4参加反应,则转移电子的物质的量为1mol
B、该反应的化学方程式为:5PbO2 + 2MnSO4 + 2H2SO4=== Pb(MnO4)2 + 4PbSO4 + 2H2O
C、Pb(MnO4)2既是氧化产物又是还原产物
D、X是MnSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com