
【题目】下列有关叙述正确的是( )
A. 由不同种元素组成的多原子分子中只存在极性键
B. NaOH溶于水既破坏了离子键也破坏了共价键
C. 硫酸氢钠受热熔融时只破坏了离子键
D. HF与HBr相比,HBr的沸点更高
科目:高中化学 来源: 题型:
【题目】曾有制药厂违反规定,购入工业用“二甘醇”代替医用丙二醇(C2H8O2)作辅料,用于“亮菌甲素注射液”的生产,导致多名患者肾功能衰歇而死亡。二甘醇又称乙二醇醚,分子式为C4H10O3(HO-CH2-CH2-O-CH2-CH2-OH),二甘醇是一种重要的化工原料,用途十分广泛。二甘醇一般的合成路线为:

请回答下列问题:
(1)下列关于“丙二醇和“二甘醇”及“乙二醇”的有关说法正确的是____________
A.丙二醇是乙二醇的同系物
B.它们具有相同种类和数目的官能团,性质上完全相同
C.“丙二醇”和“二甘醇”在病人体内都能被氧化为草酸
D.分离“丙二醇”和“二甘醇”可采用分液的方法
(2)过程I是石油加工中常用步骤,其名称为_______。
(3)从物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,写出实验室制备E的化学方程式___________,则为了能得到二甘醇D,物质B到物质C的反应条件是_________,该反应属于________(填反应类型)。写出B可能生成E的化学方程式______。
(4)反应Ⅲ的化学方程式为:____________。
(5)A的一种同系物结构简式为 请用系统命名法对其命名_______________。
请用系统命名法对其命名_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法不正确的是
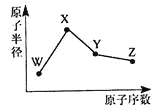
A. 对应简单离子半径:W>X
B. 对应气态氢化物的稳定性:Y<Z
C. 化合物XZW既含离子键,又含共价键
D. Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)物质的量是高中化学中常用的物理量,请完成有关其内容的填空:
①15.6 gNa2X含有0.4molNa+,Na2X的摩尔质量为_____________,含X 3.2g的Na2X 的物质的量为_____________。
②硫酸钾和硫酸铝的混合溶液,已知其中Al3+的浓度为0.4 mol/L,硫酸根离子浓度 为0.75 mol/L,则K+的物质的量浓度为__________。
(2)有以下几种物质:①纯H2SO4,②硝酸钾溶液,③铜,④二氧化碳,⑤酒精,⑥碳酸氢钠固体,⑦蔗糖,⑧NaCl晶体,⑨氨水,⑩熔融KCl。
以上能导电的是________________________(填序号,下同);
以上属于电解质的是_________________;属于非电解质的是______________。
写出属于酸式盐的物质溶于水后的电离方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 含有共价键的化合物一定是共价化合物 B. 在共价化合物中一定含有共价键
C. 含有离子键的化合物一定是离子化合物 D. 双原子单质分子中的共价键一定是非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素的原子序数,可以推知原子的①中子数 ②核电荷数 ③核外电子数 ④在周期表中的位置,其中正确的是( )
A. ①③ B. ②③ C. ①②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 金属与非金属元素形成的化合物一定是离子化合物
B. 干冰气化过程中只需克服分子间作用力
C. HF的热稳定性很好,是因为HF分子间存在氢键
D. 常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com