
| A. | 是一种非金属单质 | |
| B. | HD能在氯气中燃烧生成HCl和DCl气体 | |
| C. | 是一种化合物 | |
| D. | 在受热条件下,HD能还原氧化铜 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 0 | B. | +1 | C. | +3 | D. | +4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000mL,10.6g | B. | 1000mL,10.1g | C. | 950mL,10.1g | D. | 950mL,10.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠、氢氧化铜、氢氧化铁等物质都可作抗酸药 | |
| B. | 毒品是指由于非医疗目的而反复使用使人产生成瘾性的药品,如吗啡、冰毒等 | |
| C. | 禁止运动员在体育比赛中服用麻黄碱 | |
| D. | 用青霉素前使用者一定要进行皮肤敏感试验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g金刚石中含有C-C键4NA | |
| B. | 基态氧原子的电子排布图: | |
| C. | H2SO4、H3PO4、HClO4的酸性依次减弱 | |
| D. |  的沸点比 的沸点比 的沸点高 的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
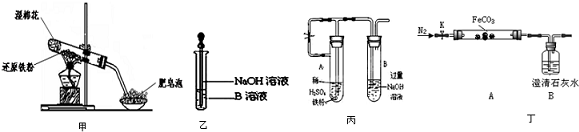
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com