
| A、将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则2SO3(g)?2SO2(g)+O2(g)△H=+Q KJ/mol |
| B、将FeCl3饱和溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
| C、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D、向含有0.4molFeBr2的溶液中通入0.3molCl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2 |


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:

| A、化学反应中分子的种类发生了改变 |
| B、该反应类型是分解反应 |
| C、反应生成的丙物质属于单质 |
| D、根据阿伏加德罗定律可推知,1个乙分子中含有2个A原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
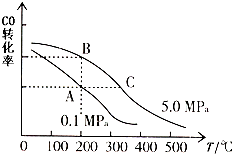 在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H
在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)═CH3OH(g)△H查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
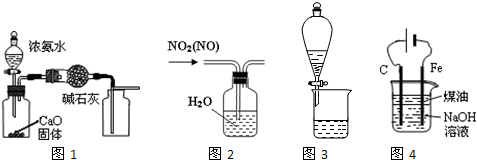
| A、用图1装置制取并收集干燥纯净的NH3 |
| B、用图2所示装置可除去NO2中的NO |
| C、用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液 |
| D、用图4装置制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大理石溶于盐酸中:CO32-+2H+=CO2↑+H2O |
| B、AlCl3溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| C、硫酸镁溶液与氢氧化钡溶液混合:SO42-+Ba2+=BaSO4↓ |
| D、氯化铁溶液中加入铜片:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色透明的水溶液中:K+、Ba2+、I-、MnO4- |
| B、含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ |
| C、能与Al反应产生H2的溶液中:HCO3-、Na+、Al3+、Br- |
| D、常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、Fe3+、SO42-、I- |
| B、Fe2+、H+、Cl-、NO3- |
| C、Na+、Al3+、AlO2-、Cl- |
| D、Mg2+、Fe2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com