
某溶液中含有NH4+、Mg2+、Fe2+、Al3+、SO42-五种离子,若向其中加入过量的氢氧化钡溶液,微热并搅拌,再加入过量的氢碘酸,溶液中大量减少的离子有( )
A.1 种 B.2 种 C.3 种 D.4 种
科目:高中化学 来源:2017届内蒙古高三上9月月考化学卷(解析版) 题型:选择题
镁粉在焰火、闪光粉中是不可缺少的原料,工业上制造镁粉是将镁蒸气在气体中冷却。下列气体中,可用来冷却镁蒸气的是( )
A.空气 B.二氧化碳 C.氮气 D.氩气
查看答案和解析>>
科目:高中化学 来源:2017届江苏省无锡市三校联合体高三上第一次月考化学试卷(解析版) 题型:实验题
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
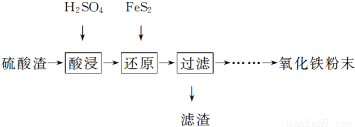
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率。② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO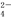 ,该反应的离子方程式为 。
,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量,以控制加入FeS2的量。实验步骤为准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-===2Fe2++SnCl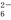
Sn2++4Cl-+2HgCl2===SnCl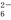 +Hg2Cl2↓
+Hg2Cl2↓
6Fe2++Cr2O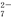 +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”或“不变”,下同)
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有的Fe3+。产生Fe3+的原因是 (用离子方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。
请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ;
b.沉淀: ;
c.过滤,洗涤;
d.烘干,研磨。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省无锡市三校联合体高三上第一次月考化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.对硝基甲苯的结构简式: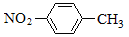
B.HClO的结构式:H-O-Cl
C.CH2F2的电子式:
D.CO2的比例模型:
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
25℃时,0.1 mol/L下列溶液的pH如下表,有关比较正确的是( )
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NaCl | CH3COONH4 | NaClO | NaHCO3 | Na2CO3 |
pH | 7.0 | 7.0 | 10.3 | 8.3[来源 | 11.6 |
A.酸性的相对强弱:HClO<HCO3-
B.由水电离产生的c(H+):① = ②
C.溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-)
D.在④⑤溶液等体积混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上学期第二次月考化学试卷(解析版) 题型:选择题
已知 ①同温度下的溶解度;Zn(OH)2 > ZnS,MgCO3 > Mg(OH)2;②溶解或电离出S2-的能力:FeS > H2S > CuS,则下列离子方程式错误的是( )
A.Mg2+ + 2HCO3-+ 2Ca2+ + 4OH- → Mg(OH)2↓+2CaCO3↓+2H2O
B.FeS + 2H+ → Fe2++ H2S↑
C.Cu2+ + H2S → CuS↓+ 2H+
D.Zn2+ + S2-+ 2H2O → Zn(OH)2↓+ H2S↑
查看答案和解析>>
科目:高中化学 来源:2017届四川省校高三上学期第二次月考化学试卷(解析版) 题型:填空题
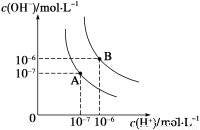
(1)水的电离平衡曲线如图所示,若A点、B点分别表示25 ℃和100 ℃时水的电离达平衡时的离子浓度。则表示25 ℃的是___________(填“A”或“B”)。100 ℃时,在1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=__________mol·L-1。100 ℃时,5×10-5 mol·L-1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为 。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的NaHCO3溶液、NaCN溶液、Na2CO3溶液、CH3COONa溶液,四种溶液的pH由大到小的顺序为_________________________。
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”)。
③向NaCN溶液中通入少量CO2,所发生反应的离子方程式为_______________________。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl?,利用Ag+与CrO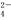 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl?恰好完全沉淀(浓度等于1.0×10?5 mol·L?1)时,溶液中c(Ag+)为___________mol·L?1,此时溶液中c(CrO
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl?恰好完全沉淀(浓度等于1.0×10?5 mol·L?1)时,溶液中c(Ag+)为___________mol·L?1,此时溶液中c(CrO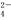 )等于__________ mol·L?1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10?12和2.0×10?10)。
)等于__________ mol·L?1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10?12和2.0×10?10)。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省实验班高三上第一次质检化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.2.0gH218O与D2O的混合物中所含中子数为NA
B.常温常压下,4.4g乙醛所含单键数目为0.7NA
C.标准状况下.5.6 LCO2与足量Na2O2反应转移的电子数为0.5NA
D.50mL1 2mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次考试化学卷(解析版) 题型:选择题
已知:葡萄糖的燃烧热是2804.0kJ·mol-1,当它氧化生成1 mol水时,放出的热量
A.26.0kJ B.51.9 kJ C.155.8kJ D.467.3kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com