
| A. | 乙烯中 C=C 的键能是乙烷中 C-C 的键能的 2 倍 | |
| B. | 同一原子中,2p,3p,4p 能级的轨道数目依次增多 | |
| C. | C-O 键的极性比 N-O 键的极性大 | |
| D. | 根据能量最低原理,原子的核外电子排布先填满离核近的轨道,再填充离核远的轨道 |
分析 A.乙烯分子中碳碳双键的键能小于乙烷中碳碳单键键能的2倍;
B.p能级含有三个原子轨道;
C.二者非金属性差距越大极性越大;
D.在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低.
解答 解:A.乙烯分子中碳碳双键的键能小于乙烷中碳碳单键键能的2倍,所以导致乙烯性质较活泼,故A错误;
B.p能级含有三个原子轨道,所以同一原子中,2p,3p,4p 能级的轨道数目相同,故B错误;
C.二者非金属性差距越大极性越大,所以C-O 键的极性比 N-O 键的极性大,故C正确;
D.在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,但不一定是近的轨道能量低,例如能量:3d>4s,即先填充4s,再填充3d轨道,故D错误;
故选C.
点评 本题考查化学键、能级、电负性、能量最低原理等知识点,侧重基础知识的考查,知道极性大小判断方法、杂化轨道理论内涵,题目难度不大.


科目:高中化学 来源: 题型:推断题
 ;CCH3OH;D
;CCH3OH;D ;ECH3COOH.
;ECH3COOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| c(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A. | 容器甲中的反应在前2min的平均速率v(SO2)=0.05mol•L-1•min-1 | |
| B. | 达到平衡时,容器丙中正反应速率与容器甲相等 | |
| C. | 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0 | |
| D. | 容器乙中若起始时改充0.10mol•L-1NO2和0.20mol•L-1SO2,达到平衡时c(NO)与原平衡不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:F>O>N | |
| B. | 离子晶体中一定存在离子键 | |
| C. | CCl4和NH3都是以极性键结合的极性分子 | |
| D. | 白磷为分子晶体,分子结构为正四面体,其键角为109.5° |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②①④③ | B. | ③②①④ | C. | ③①②④ | D. | ③①④② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 3:2:2 | C. | 1:2:3 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
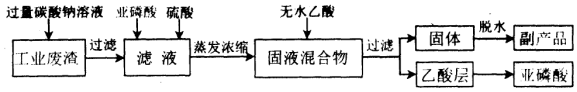
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
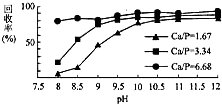 三氯氧磷(POCl3)常温下为无色液体,有广泛应用,近年来,三氯氧磷的工业生产由三氧化磷的“氯气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).
三氯氧磷(POCl3)常温下为无色液体,有广泛应用,近年来,三氯氧磷的工业生产由三氧化磷的“氯气直接氧化法”代替传统的三氯化磷“氯化水解法”(由氯气、三氯化磷和水为原料反应得到).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com