
下列化学用语使用正确的是
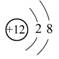 A.Mg2+结构示意图: B.含18个中子的氯原子的核素符号:
A.Mg2+结构示意图: B.含18个中子的氯原子的核素符号: Cl
Cl
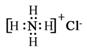 C.NH4Cl的电子式: D.四氯化碳分子球棍模型:
C.NH4Cl的电子式: D.四氯化碳分子球棍模型: 
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
下列反应的离子方程式中,正确的是( )
A.二氧化氮与水反应:3NO2+H2O===NO+2H++2NO3-
B.二氧化硫与氢氧化钠溶液反应:SO2+OH-===SO32-+H2O
C.硫酸与氢氧化钡溶液反应:H++OH-===H2O
D.氧化铝与氢氧化钠溶液反应:Al2O3+2OH-===2AlO2-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N(部分产物及反应条件已略去)。
(1)生成M、N的反应类型分别是 、 ; D的结构简式是 。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种。C的结构简式是 。
(3)由苯酚生成A的化学方程式是 。
B与C反应的化学方程式是 。
(4)以苯酚为基础原料也可以合成芳香族化合物F。经质谱分析F的相对分子质量为152,其中氧元素的质量分数为31.6%,F完全燃烧只生成CO2和H2O。则F的分子式是 。
已知:①芳香族化合物F能发生银镜反应,且还能发生水解反应;
②F的核磁共振氢谱显示其分子中含有4种氢原子;
③分子结构中不存在“-O-O- ”的连接方式。F的结构简式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因.假设某纳米颗粒中粒子分布类似于硼镁化合物,其结构如图所示,则这种纳米颗粒的分子式为( )
A.MgB B.Mg3B6 C.Mg5B12 D.Mg14B6
( 镁原子○位于顶点和上下两个面心,硼原子●位于内部 )
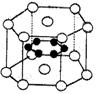
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 ,第一电离能最小的元素是 (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是
(填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、
另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6
pm,则此晶胞的密度为  (保留两位有效数字)。(
(保留两位有效数字)。(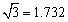 )
)

(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构
如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出
上述过程的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mo l·L-1 HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
l·L-1 HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
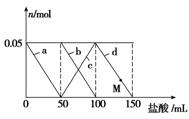
A.a曲线表示的离子方程式为:AlO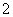 +H++H2O===Al(OH)3↓
+H++H2O===Al(OH)3↓
B.b和c曲线表示的离子反应是相同的
C.M点时,溶液中沉淀的质量为3.9 g
D.原混合溶液中的CO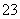 与AlO
与AlO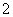 的物质的量之比为1∶2
的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]晶体的成分中含有NH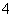 、Fe2+、SO
、Fe2+、SO
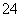 和H2O,下列实验叙述中不正确的是
和H2O,下列实验叙述中不正确的是
A.取少量硫酸亚铁铵晶体放入试管中,加热,试管口有液体生成 ,则可证明晶体的成分中含有结晶水
,则可证明晶体的成分中含有结晶水
B.取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液 ,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH
,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH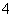
C.取适量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO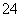

D.取适量硫酸亚铁铵晶体溶于水,得浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
人体血液里Ca2+离子的浓度一般采用mg/mL来表示。加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出。试回答:
(1)现需要80 mL 0.02 mol·L-1标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯、玻璃棒和______________________;配制时, KMnO4溶液应用强酸酸化,本实验选择________作酸化剂。若选择HNO3酸化,则结果可能________(填“偏大”“偏小”或“不变”)。
(2)草酸与酸性KMnO4溶液反应的离子方程式为_______________________________。
(3)滴定时,根据现象_______________________________________,即可确定反应达到终点。
(4)滴定的实验数据如下所示:
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
经过计算,血液样品中Ca2+离子的浓度为________mg/mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的做法正确的是
A.用pH试纸测氯水的pH
B.用托盘天平称取5.72 g NaCl晶体
C.用酸式滴定管量取20.00 mL的酸性KMnO4溶液
D.用带磨口玻璃塞的试剂瓶保存Na2CO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com