
【题目】A、B、X、Y 和 Z 是原子序数依次递增的短周期元素。其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子的化合物;B与Z 的最外层电子数之比为 2∶3,常见化合物Y2X2与水反应生成X的单质,其水溶液可使酚酞试液变红。请回答下列问题:
(1)Z 元素在元素周期表中的位置是______________ ,化合物 B2A4 的电子式为______________
(2)化合物A2X和A2Z中,沸点较高的是__________(填化学式),其主要原因是_____________
(3)A与X、A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为:_______
(4)将Z与X 形成的气态化合物ZX2通入Ba(NO3)2 溶液中,有白色沉淀和NO气体生成,发生反应的离子方程式为___________________, 由此可得出一氧化氮与ZX2的还原性大小关系为________________
(5)将Y2X2投入到Y2Z的水溶液中可生成Z的单质,发生反应的离子方程式为:______________,并用单线桥标出此反应中电子转移的方向和数目。
(6)两种均含A、X、Y、Z四种元素的化合物相互反应放出气体的反应离子方程式为:_________
【答案】 第三周期第 VIA 族 ![]() H2O 水分子间存在氢键 H2O2 + H2S = S↓+ 2H2O 3SO2 + 3Ba2+ + 2NO3- + 2H2O = 3BaSO4↓+ 2NO + 4H+ SO2 > NO
H2O 水分子间存在氢键 H2O2 + H2S = S↓+ 2H2O 3SO2 + 3Ba2+ + 2NO3- + 2H2O = 3BaSO4↓+ 2NO + 4H+ SO2 > NO ![]() HSO3-+ H+ = SO2↑+ H2O
HSO3-+ H+ = SO2↑+ H2O
【解析】A、B、X、Y和Z是原子序数依次递增的短周期元素,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,Y2X2为Na2O2,则X为O元素,则Y为Na元素;A与X可形成10个电子化合物,A与Y同主族,则A为H元素;X与Z同主族,则Z为S元素;B与Z的最外层电子数之比为2:3,则B元素的最外层电子数为4,A与B可形成10个电子化合物,B为C元素。
(1)S元素在元素周期表中的位置是第三周期第 VIA 族,化合物 C2H4 的电子式为![]() ;
;
(2)化合物H2O和H2S 中,沸点较高的是H2O,因为水分子间形成氢键;
(3)H与O、H与S均能形成18个电子的化合物,分别是:H2O2、H2S,H2O2 可将 H2S氧化成S,故方程式为:H2O2 + H2S = S↓+ 2H2O;
(4)将S与O 形成的气态化合物SO2通入 Ba(NO3)2溶液中,有白色沉淀和NO气体生成,发生反应的离子方程式为: 3SO2+3Ba2++2NO3- + 2H2O = 3BaSO4↓+2NO+4H+;根据还原剂的还原性大于还原产物的还原性,故还原性:SO2>NO;
(5)将Na2O2投入到Na2S的水溶液中可生成S的单质,Na2O2将Na2S氧化成S,反应的离子方程式为:![]() ;
;
(6)两种均含 H、O、Na、S四种元素的化合物为:NaHSO3和NaHSO4,相互反应放出气体的反应离子方程式为:HSO3-+ H+ =SO2↑+H2O。


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】关于2mol二氧化碳的叙述中,正确的是( )
A. 质量为44g B. 含有4mol O C. 分子数为6.02×1023 D. 共有3mol原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为。
(2)X与M组成的物质为(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为。
(3)Y在周期表中的位置是 , 其含氧酸的化学式为。
(4)L与M形成的化合物中L的化合价是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)Si(g)+4HCl(g);△H=+Q kJmol﹣1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C.反应至4min时,若HCl浓度为0.24 mol/L,则H2的反应速率为0.03 mol/(Lmin)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100mL 1molL﹣1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气是制备含氮化合物的一种重要物质,而含氮化合物的用途广泛,如图表示两个常见固氮反应的平衡常数对数值(IgK)与温度的关系:
①N2+3H22N2H3 ②N2+3O22NO
根据图中的数据判断下列说法正确的是( )
A.反应①和②均为放热反应
B.升高温度,反应①的反应速率减小
C.在常温下,利用反应①固氮和利用反应②固氮反应程度相差很大
D.在1000℃时,反应①和反应②体系中N2的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)2NO2(g)达到平衡时NO的转化率,则压强最大的点为( ) 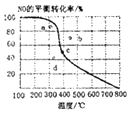
A.a
B.b
C.c
D.d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 18gD2O含有电子数为10NA
B. 46g NO2和N2O4的混合物中所含氮原子个数为6.02×10![]()
C. 0.1mol过氧化钠与足量的水反应,转移的电子数为 0.2NA
D. 50 mL 12 mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com