
【题目】(1)第ⅢB族有_____种元素,第117号元素属于_________元素(填“金属”或“非金属”);
(2)第5周期第ⅤA族元素的元素名称为_________,原子序数为_______;
(3)第4周期元素硒的某一核素含有46个中子,该元素的原子符号为_______;
(4)![]() 和
和![]() 是元素X的两种稳定的天然同位素,它们的原子质量分别为a g和b g,在自然界中所占的原子百分比分别为m%和n%,已知12C原子的质量为W g,则
是元素X的两种稳定的天然同位素,它们的原子质量分别为a g和b g,在自然界中所占的原子百分比分别为m%和n%,已知12C原子的质量为W g,则![]() 的相对原子质量为___________,元素X的近似相对原子质量为______________________。
的相对原子质量为___________,元素X的近似相对原子质量为______________________。
【答案】 32 金属 锑 51 ![]()
![]() A×m%+B×n%
A×m%+B×n%
【解析】分析:(1)根据元素周期表的结构分析;
(2)根据元素周期表的结构分析;
(3)根据硒的质子数计算质量数,进而书写该核素的原子符号;
(4)原子的相对原子质量是一个原子的真实质量与一个![]() 原子质量的
原子质量的![]() 的比值;元素的相对原子质量是该元素各种核素原子的相对原子质量与其在自然界中所占原子个数百分比的乘积之和。
的比值;元素的相对原子质量是该元素各种核素原子的相对原子质量与其在自然界中所占原子个数百分比的乘积之和。
详解:(1)第ⅢB族由于含有镧系和錒系,因此有32种元素,第117号元素位于第七周期第ⅦA,因此属于金属元素;
(2)第5周期第ⅤA族元素的元素名称为锑,氮元素的原子序数是7,则锑的原子序数为7+8+18+18=51;
(3)第4周期元素硒的质子数是8+8+18=34,若某一核素含有46个中子,则该核素的质量数是34+46=80,因此该元素的原子符号为![]() ;
;
(4)已知12C原子的质量为W g,则![]() 的相对原子质量为
的相对原子质量为![]() 。核素的近似相对原子质量可以看作是质量数,则元素X的近似相对原子质量为A×m%+B×n%。
。核素的近似相对原子质量可以看作是质量数,则元素X的近似相对原子质量为A×m%+B×n%。


科目:高中化学 来源: 题型:
【题目】碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用,实验小组进行碘单质的制备。
【查阅资料】碱性条件下,I2会发生歧化反应生成I-和IO3-,酸性条件下, I-和IO3-又会发生归中反应生成I2;碘在水中的溶解度为0.029g。
【碘的制取】以海带为原料,按照以下步骤进行实验。

(1)将海带灼烧成灰后再用水浸取,目的是_______________。
(2)步骤B发生的反应是“氧化”,这一操作中可供选用的试剂: ①Cl2;②Br2;③稀硫酸和H2O2,从无污染角度考虑,你认为合适试剂是______(填编号),反应中I-转化为I2 的离子反应方程式为_______________。
(3)步骤C中使用的起到分离作用的仪器是_____________,使用该仪器时,第一步操作是_______________。
(4)有同学查资料后发现CCl4有毒,提议用乙醇代替,请判断该提议是否可行,原因是_______________。
【碘的分离】得到含I2的CCl4溶液后,利用右图装置进行碘的提取并回收溶剂。
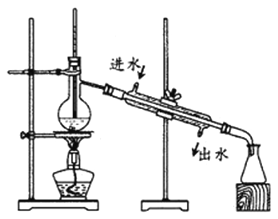
(5)图中有两处明显错误,分别是①_________;②_________。
(6)对实验装置的错误改正之后进行分离操作。预期锥形瓶中得到无色的CCl4,实验结果锥形瓶中得到紫红色液体,请分析出现该实验结果的原因____________,为了保证实验成功,请提出改进方案:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钻、钙等多种化学物质。
请回答下列问题:
(1) 区分晶体硼和无定形硼最可靠的科学方法为___________。第二周期元素的电负性按由小到大的顺序排列,B元素排在第__________位,其基态原子价层电子的电子云轮廊图为 _______________。
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为____________,Si原子的杂化类型为__________________。
(3) N元素位于元素周期表_____________区;基态N原子中,核外电子占据最高能级的电子云有______伸展方向。

(4)[Co(NH3)6]3+的几何构型为正八面体形,Co在中心。
①[Co(NH3)6]3+中,1个Co提供_______________个空轨道。
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成_____________种不同的结构形式。
(5)—种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。
①与Ti紧邻的Ca有___________________个。
②若Ca与O之间的最短距离为α pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g· cm-3(用含α、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol L-1的HC1溶液,测得溶液中某几种离子的物质的量的变化情况如图所示。下列说法不正确的是

A. b和c曲线表示的离子反应均为CO32-+H+= HCO3-
B. 结合H+的能力:AlO2->CO32-> HCO3->Al(OH)3
C. M点时A1(OH)3的质量等于3.9 g
D. 原混合溶液中,CO32-与AlO2-的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体可能含有NH4+、Cu2+、Na+、Cl﹣、CO32﹣、SO42﹣中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
①一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀4.46g,在沉淀中加入过量稀盐酸,沉淀没变化.
②另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(保准状况).
下列说法正确的是( )
A.该固体中一定含有NH4+、SO42﹣、Na+
B.该固体中一定没有Cu2+、Cl﹣
C.该固体中只含有NH4+、CO32﹣、SO42﹣、Cl﹣
D.根据以上实验,无法确定该固体中有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1molX气体跟amolY气体在体积可变的密闭容器中发生如下反应:X(g)+aY(g)![]() bZ(g).反应达到平衡后,测得X的转化率为25%.而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的5/6,则a和b数值可能是( )
bZ(g).反应达到平衡后,测得X的转化率为25%.而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的5/6,则a和b数值可能是( )
A. a=1,b=2 B. a=1,b=3
C. a=2,b=3 D. a=2,b=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
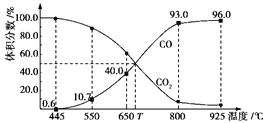
已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的叙述中正确的是( )
A.第IA族元素都是金属元素
B.第VIA族元素的单质在常温下均为气体
C.第二、三周期中的金属元素种类一 样多
D.短周期包括第一、二、三周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar] , 有个未成对电子.
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是 .
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因 .
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | ﹣49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂.Zn、Ge、O电负性由大至小的顺序是 .
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为微粒之间存在的作用力是 .
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,如图(1、2)为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ![]() ,0,
,0, ![]() );C为(
);C为( ![]() ,
, ![]() ,0).则D原子的坐标参数为 .
,0).则D原子的坐标参数为 .
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76pm,其密度为gcm﹣3(列出计算式即可).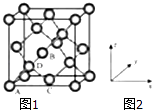
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com