
【题目】某温度时,在一个2 L的密闭容器中,X、Y、Z(均为气体)三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:
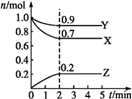
(1)该反应的化学方程式为___________________________。
(2)2 min时反应达到平衡,此时体系内压强与开始时的压强之比为________。
达到平衡时,容器内混合气体的平均相对分子质量比起始时____(填增大、减小或相等)。
(4)若要加快该反应的速率,可以采取的措施有(_____)
A.扩大密闭容器的体积 B.适当升高温度 C.加入正催化剂 D.减小Y的用量
(5)已知该反应为放热反应,2 min后,若要使平衡正向移动,可以采取的措施有(_________)
A.缩小密闭容器的体积 B.适当降低温度 C.加入正催化剂 D.增大Z的用量
【答案】 3X+Y![]() 2Z 9:10 增大 BC AB
2Z 9:10 增大 BC AB
【解析】(1)根据图像可知反应进行到2min时物质的量不再发生变化,此时X减少0.3mol,Y减少0.1mol,Z增加0.2mol,因此该反应的化学方程式为3X+Y![]() 2Z。(2)压强之比是物质的量之比,2 min时反应达到平衡,此时体系内压强与开始时的压强之比为
2Z。(2)压强之比是物质的量之比,2 min时反应达到平衡,此时体系内压强与开始时的压强之比为![]() 。(3)正反应体积减小,混合气体的质量不变,因此达到平衡时,容器内混合气体的平均相对分子质量比起始时增大。(4)A.扩大密闭容器的体积压强减小,反应速率减小,A错误;B.适当升高温度加快反应速率,B正确;C.加入正催化剂加快反应速率,C正确;D.减小Y的用量,浓度减小,反应速率减小,D错误,答案选BC;(5)A.正反应体积减小,缩小密闭容器的体积压强增大,平衡向正反应方向进行,A正确;B.正反应放热,适当降低温度,平衡向正反应方向进行,B正确;C.加入正催化剂不改变平衡状态,C错误;D.增大Z的用量,Z的浓度增大,平衡向逆反应方向进行,D错误,答案选AB。
。(3)正反应体积减小,混合气体的质量不变,因此达到平衡时,容器内混合气体的平均相对分子质量比起始时增大。(4)A.扩大密闭容器的体积压强减小,反应速率减小,A错误;B.适当升高温度加快反应速率,B正确;C.加入正催化剂加快反应速率,C正确;D.减小Y的用量,浓度减小,反应速率减小,D错误,答案选BC;(5)A.正反应体积减小,缩小密闭容器的体积压强增大,平衡向正反应方向进行,A正确;B.正反应放热,适当降低温度,平衡向正反应方向进行,B正确;C.加入正催化剂不改变平衡状态,C错误;D.增大Z的用量,Z的浓度增大,平衡向逆反应方向进行,D错误,答案选AB。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是
A. 氧化性:Cu2+>Fe2+ B. 酸性:HI>HCl
C. 共用电子对偏移程度:N-H键>C-H键 D. 碱性:NaOH>Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物转化所需的试剂、反应条件中,不正确的是
A. 醇→烯烃:浓硫酸,加热 B. 醛→羧酸:银氨溶液,水浴加热
C. 苯→溴苯:溴水,铁 D. 酸→酯:浓硫酸,加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入0.6mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如下图。已知甲、乙两室中气体的质量之差为10.9g。

(1)甲室中气体的物质的量为__________mol。
(2)甲室中NH3,H2的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。而在硫酸的生产中,最关键的一步反应为:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)一定条件下,SO2与O2反应10 min后,若SO2和SO3物质的量浓度分别为0.1 mol/L和0.3 mol/L,则10 min内生成SO3的化学反应速率为___________;SO2的转化率为___________。
(2)下列关于该反应的说法正确的是_________。
A.增加O2的浓度能加快反应速率 B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率 D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中若某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是______。
A.O2为0.2 mol/L B.SO2为0.25 mol/L
C.SO3为0.4 mol/L D.SO2、SO3均为0.15 mol/L
(4)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(l)元素M的离子与NH4+所含的电子数和质子数均相同,含有元素M 的化合物Q是淡黄色固体,写出Q与水反应的离子方程式:_________。加入酚酞指示剂,反应过程中的现象是____________。
(2)将Cl2通入到含等物质的量的FeBr2溶液中充分反应的离子方程式为____________。
(3)NH4NO3为爆炸物,在不同温度下受热分解,可发生不同的化学反应:
在110℃时:NH4NO3=NH3 + HNO3
在185~200℃时:NH4NO3=N2O + 2H2O
在230℃以上时,同时有弱光:2 NH4NO3=2N2+O2 + 4H2O
在400℃以上时,发生爆炸:4 NH4NO3=3N2+2NO2+8H2O
上述反应过程中被破坏的化学键的类型是____________。
(4)H2O2可作为矿业废液消毒剂,有“绿色氧化剂”的美称。消除采矿业废液中的氰化物(如KCN), 经以下反应实现:KCN+H2O2+H2O=A+NH3↑,写出KCN的电子式:_____;生成物A的化学式为_____。
(5)X、Y在周期表中位于同一主族相邻的两种元素,化合物Cu2X和Cu2Y可发生如图所示的转化: (其中D是纤维素水解的最终产物)
![]()
Cu2X与过量浓HNO3反应有红棕色气体生成,该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各离子或原子的电子排布式错误的是( )
A.Ca2+:1s22s22p63s23p6B.O2-:1s22s22p4
C.K: 1s22s22p63s23p64s1D.Fe3+:1s22s22p63s23p63d5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com