
【题目】BeCl2熔点较低,易升华,溶于醇和醚,其化学性质与AlCl3相似。由此可推测BeCl2
A.熔融态不导电B.水溶液呈中性
C.熔点比BeBr2高D.不与氢氧化钠溶液反应
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Al箔插入稀HNO3中,无现象,说明Al箔表面被HNO3氧化,形成致密的氧化膜
B. 如图所示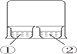 ,①中为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成
,①中为AlCl3溶液,②中为浓氨水,①中有白色沉淀生成
C. AlCl3![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
D. AlCl3溶液中滴加NaOH溶液后铝的存在形式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月18日,我国海域天然气水合物试采成功,下列分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是 Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的是 ( )

A. 该分析仪工作时,电极a为正极
B. 电极a的反应式为:CH4 + 10OH--8e-=CO32-+7H2O
C. 当固体电解质中有1 mol O2-通过时,电子转移4mol
D. 该分析仪可用于分析空气中的天然气的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸;当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
当X是强酸时A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。
请回答:
(1)A是________,Y是________,Z是________。
(2)当X是强酸时,E是________,写出B生成C的化学方程式:________________________
(3)当X是强碱时,E是________,写出B生成C的化学方程式:________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于葡萄糖的叙述中,错误的是( )
A.能与氢气发生加成反应,生成六元醇B.因为含醛基—CHO,能发生银镜反应
C.能与醇发生酯化反应D.能被氧化为CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在生产生活中应用广泛。回答下列问题:
(1)铁铵矾是一种化学物质,分子式是NH4Fe(SO4)2·12H2O,其溶于水后,溶液中的离子浓度大小关系为_____________________。
(2)已知某溶液中含有CO32-、SO42-等离子,取一定量的该溶液,向其中滴加BaCl2溶液,当CO32-开始沉淀时,溶液中![]() =_____。(已知Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9)
=_____。(已知Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9)
(3)已知:S2Cl2(l)+Cl2(g)=2SCl2(l) ΔH=-50.2 kJ·mol-1。断裂1mol Cl-Cl键、1mol S-S键分别需要吸收243kJ、268kJ的能量,则断裂1mol S-Cl键需要吸收的能量为_____________kJ。
(4)某容积不变的密闭容器中发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H=-197 kJ·mol-1。
2SO3(g) △H=-197 kJ·mol-1。
①下列能说明反应达到平衡状态的是 ________________
a.体系压强保持不变 b.混合气体的密度保持不变
c.SO3和O2的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol SO2
②向同温、同体积的两个密闭容器中分别充入气体:(甲)2 mol SO2 和1 mol O2;(乙) 1 mol SO2 和0.5 mol O2 ;恒温、恒容下反应达平衡时,两个容器内的压强大小关系为____(用p甲、p乙表示)。
(5)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可以制备H2SO4,其原理如下图所示(电极材料为石墨)。

阳极的电极反应式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,选用了如下图所示的实验装置。

(1)写出浓硫酸与木炭粉在加热条件下的化学方程式______________________。
(2)①中无水硫酸铜的作用是___________________________。
(3)②中酸性KMnO4溶液的作用是__________________________。
(4)②中两次用到品红溶液,它们的作用分别是
A_____________________, B ___________________ 。
(5)③中出现的现象____________________________________________________,
发生反应的离子方程式_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)===2HF(g) ΔH=-546.6 kJ/mol,下列说法正确的是 ( )
A. 氟化氢气体分解生成氢气和氟气的反应是放热反应
B. 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于546.6 kJ
C. 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF的能量
D. 该反应中的能量变化可用如图来表示

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com