
【题目】相同温度下,体积为2L的两个恒容容器中发生:![]() 均为气态物质
均为气态物质![]() 有下表所示实验数据:
有下表所示实验数据:
容器编号 | 起始时各物质的物质的量 | 达到平衡时体系能量的变化 | ||
|
|
| ||
① | 1 | 3 | 0 |
|
② | 0 | 0 | 2 |
|
③ |
|
|
|
|
下列有关说法正确的是
A.![]()
B.②中![]() 的转化率大于③中
的转化率大于③中![]() 的转化率
的转化率
C.容器①与③分别达到平衡时,平衡常数相同,且![]()
D.将容器①的反应条件换为恒温恒压中进行![]() 投料量不变
投料量不变![]() ,达到平衡时,气体平均摩尔质量较恒温恒容时减小了
,达到平衡时,气体平均摩尔质量较恒温恒容时减小了
【答案】B
【解析】
将表中三个容器中的各物质都折算成反应物氢气和氮气的物质的量,可知,它们都分别为3mol和1mol,所以这三个容器中的反应为等效平衡,且是完全等效,因为容器①中达到平衡时能量变化为![]() ,为反应热的一半,所以可知平衡时氮气和氢气的物质的量分别为
,为反应热的一半,所以可知平衡时氮气和氢气的物质的量分别为![]() 和
和![]() ,生成的氨气为1mol,所以平衡时
,生成的氨气为1mol,所以平衡时![]() 、
、![]() 、
、![]() 的浓度分别为
的浓度分别为![]() 、
、![]() 、
、![]() 。
。
A. 由图中数据可知,在容器③中转化的氨气的物质的量小于容器②中的,所以吸收的热小于容器②中,即![]() ,故A错误;
,故A错误;
B. 容器②中氨气的转化率为![]() ,容器③中氨气的转化率为
,容器③中氨气的转化率为![]() ,故B正确;
,故B正确;
C. 根据平衡常数的定义可知![]() ,故C错误;
,故C错误;
D. 由于该反应为体积减小的反应,当恒温恒压时,容器的体积减小,物质的量也减小,而气体的质量守恒,所以气体平均相对分子质量会增大,故D错误。
故选B。


科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是 ( )
CO(g) + Cl2(g) ΔH > 0,当反应达到平衡时,改变一种反应条件,下列示意图正确的是 ( )

① ② ③ ④
A. ①表示随温度升高,平衡常数的变化
B. ②表示加入催化剂,反应速率随时间的变化
C. ③表示恒压条件下,反应物的转化率随充入惰性气体体积的变化
D. ④表示CO的体积分数随充入Cl2量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)2XY(g)△H>0,达到甲平衡.在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
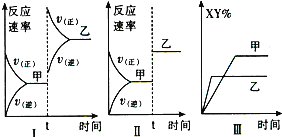
A. 图I是升高温度的变化情况
B. 图Ⅱ是扩大容器体积的变化情况
C. 图Ⅲ是增大压强的变化情况
D. 图Ⅲ是升高温度的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态S原子电子占据最高能级的电子云轮廓图为___形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是__。
(3)图(a)为S8的结构,其硫原子的杂化轨道类型为___。
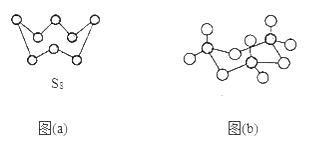
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为___形;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,互为同分异构体的是
A.CH3CH2CH3 和CH3CH(CH3)CH3B.CH3CH2OH 和 CH3CHO
C.CH3COOH 与 HCOOCH3D.![]() 和
和 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 14g乙烯中所含氢原子数为2NA
B. 6g14C原子中所含中子数为4NA
C. 标准状况下2.24LHC1气体中所含H+数为0.1NA
D. 0.1mol氯气溶于水制成饱和氯水,转移电子数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由一氯乙烷合成乙二醇的线路如下:
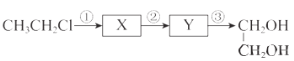
(1)反应①发生消去反应,反应试剂和条件为________________。
(2)反应②选用的无机试剂为_________________。
(3)反应③的化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
元素 | 相关信息 |
Y | 原子核外有6个不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布式为3d64s2 |
M | ⅠB族,其单质常用作导线 |
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是_____________________,M2+的核外电子排布式为________________________。
(2)写出两个与YZ2互为等电子体的化学式_________________ 。
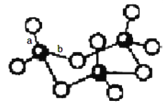
(3)WZ2分子中W原子价层电子对数是_____________对,WZ2的VSEPR 模型名称为_______________,WZ3气态为单分子,该分子中W原子的杂化轨道类型为__________________;WZ3的三聚体环状结构如图所示,该结构中W原子的杂化轨道类型为__________;该结构中W-Z键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为___________(填图中字母) ,该分子中含有______个σ键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 电解饱和MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B. 向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-===2MnO2↓+3SO42-+2H2O
C. 向Fe(NO3)2稀溶液中滴加足量氢碘酸:3Fe2++NO3-+4H+===3Fe3++NO↑+2H2O
D. 向NaClO溶液中通入足量CO2:ClO-+CO2+H2O===HClO+HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com