
 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图所示.下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如图所示.下列判断正确的是( )| A、该反应的还原剂是Cl- |
| B、消耗1mol还原剂,转移6mol电子 |
| C、氧化剂与还原剂的物质的量之比为2:3 |
| D、反应后溶液的酸性明显增强 |


科目:高中化学 来源: 题型:
 已知甲、乙、丙、X、Y为中学化学常见物质,其中甲、乙、丙中均含有元素A,其转化关系如图所示(反应条件已省略):
已知甲、乙、丙、X、Y为中学化学常见物质,其中甲、乙、丙中均含有元素A,其转化关系如图所示(反应条件已省略):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在Na2O、Na2O2中,阳离子和阴离子个数比分别是2:1和1:1 |
| B、常温常压下,11.2L SO2气体中含有的分子数为0.5NA |
| C、一定条件下,密闭容器充入1mol N2和3mol H2充分反应,转移电子的数目为6NA |
| D、Na2CO3溶液中,若CO32-数目为NA,则Na+数目大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置①研究的是电解CuCl2溶液,b电极上有红色固体析出 |
| B、装置②研究的是金属的吸氧腐蚀,Fe上的反应为Fe-2e-=Fe2+ |
| C、装置③研究的是电解饱和食盐水,B电极发生的反应:2Cl--2e-=Cl2↑ |
| D、三个装置中涉及的主要反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有② | B、①③ | C、②④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质、原子、化合物 |
| B、元素、单质、化合物 |
| C、无机化合物、元素、有机化合物 |
| D、原子核、原子、分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
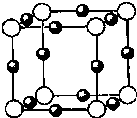 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a mol/L的HCN溶液与b mol/L的NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b |
| B、常温,CH3COONa溶液的pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7mol/L |
| C、常温下,0.1mol/L的某酸溶液中,若c(OH-)/c(H+)=1×10-8,则溶液中由水电离出的c(H+)=1×10-11mol/L |
| D、在0.1mol/L的Na2SO3溶液中加入少量NaOH固体,c(SO32-)与c(Na+)均增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com