
| A. | SO2既是氧化产物又是还原产物 | |
| B. | CuFeS2既是氧化剂又是还原剂 | |
| C. | O2只做氧化剂 | |
| D. | 若有1mol O2参加反应,则反应中有4mol电子转移 |
分析 2CuFeS2+O2=Cu2S+2FeS+SO2中,Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,氧气中O元素由0降低为-2价,以此来解答.
解答 解:A.S元素由-2价升高到+4价,氧气中O元素由0降低为-2价,则SO2既是氧化产物又是还原产物,故A正确;
B.CuFeS2中Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,则CuFeS2既是氧化剂又是还原剂,故B正确;
C.氧气中O元素由0降低为-2价,则O2只做氧化剂,故C正确;
D.若有1molO2参加反应,则反应中共有6mol电子转移,故DC错误.
故选D.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,明确元素的化合价是解答本题的关键,CuFeS2中各元素的化合价是解答的难点和易错点,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 溶液中加入HCl酸化后,再加入BaCl2溶液,有白色沉淀产生,则溶液中含有SO42- | |
| B. | 溶液中加入KSCN溶液,无红色出现,继续加入氯水,溶液变红,说明溶液中一定含有Fe2+ | |
| C. | 溶液中加入NaOH溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可推测该溶液中含有NH4+ | |
| D. | 向溶液中加入盐酸,有使澄清石灰水变浑浊的无色无味的气体放出,可推测溶液中含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物熔沸点较高、共价化合物熔沸点较低 | |
| B. | 非金属原子间不可能形成离子化合物 | |
| C. | 确定某化合物为离子化合物,可以用融化时能否导电来判断 | |
| D. | 共价化合物中可能有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
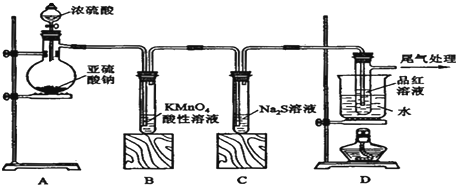
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓溴水除去苯中的苯酚 | |
| B. | 除去苯中的少量甲苯,先用酸性高锰酸钾溶液,后用氢氧化钠溶液处理 | |
| C. | 在加热条件下,用乙醇除去乙酸乙酯中的乙酸 | |
| D. | 将溴乙烷和氢氧化钠溶液混合加热后,再加入硝酸银溶液,检验溴元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 1molAl与足量的该硫酸反应产生3g氢气 | |
| C. | “化学纯”是指这种硫酸只含H2SO4和H2O分子 | |
| D. | 配制460mL2.3mol•L-1的稀硫酸需量取该硫酸62.5 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
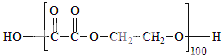 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.
无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75.00% | 11.44% | 13.56% |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;D原子的结构示意图
;D原子的结构示意图 .
. ,A、C、D形成的化合物中的化学键类型有离子键和共价键,B和C形成的化合物BC2的结构式O=C=O.
,A、C、D形成的化合物中的化学键类型有离子键和共价键,B和C形成的化合物BC2的结构式O=C=O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com