
����Ŀ��ij�¶�ʱ����һ��2L���ܱ������У�X��Y��Z�������ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�

��1���÷�Ӧ�Ļ�ѧ����ʽΪ_________
��2����Ӧ��ʼ��2min��������Z��ʾ��ƽ����Ӧ����Ϊ_________��
��3����X��Y��Z��Ϊ���壬2min��Ӧ�ﵽƽ�⣬��Ӧ��ƽ��ʱ��
�ٴ�ʱ��ϵ��ѹǿ�ǿ�ʼʱ��______����
�ڴ�ƽ��ʱ�������ڻ�������ƽ����Է�����������ʼͶ��ʱ________���������С������ȡ�����
��4���˷�Ӧ��ƽ�����ֻ�Ӵ���ϵѹǿ��Z�����ʵ������٣���Y�����壬��X��״̬��_______��
���𰸡� 3X+Y![]() 2Z 0.05mol/��L��min�� 0.9 ���� �������Һ��
2Z 0.05mol/��L��min�� 0.9 ���� �������Һ��
����������1������ͼ���֪����Ӧ���е�2minʱ���ʵ�Ũ�Ȳ��ٷ����仯��˵����Ӧ�ﵽƽ��״̬����ʱ����X��Y�����ʵ����ֱ���0.3mol��0.1mol������Z�����ʵ�����0.2mol�����Ը��ݱ仯��֮������Ӧ�Ļ�ѧ������֮�ȿ�֪���÷�Ӧ�Ļ�ѧ����ʽ��3X��Y![]() 2Z��
2Z��
��2���ӿ�ʼ��2min��Z��ƽ����Ӧ����Ϊ![]() ��0.05mol/(L��min)��
��0.05mol/(L��min)��
��3�������¶Ȳ���ʱ�������ѹǿ�������������ʵ��������ȣ���Ӧǰ��������ʵ���Ϊ2mol����Ӧ��ʼ��2min������ĵ����ʵ���Ϊ1.8mol����ʱ��ϵ��ѹǿ�ǿ�ʼʱ��0.9�����ڷ�Ӧǰ���������������䣬����������ʵ����ڼ��٣�ƽ��ʱ�������ڻ�������ƽ����Է�������������
��4���˷�Ӧ��ƽ�����ֻ�Ӵ���ϵѹǿ��ʹZ�����ʵ������٣�ƽ�������ƶ�����XӦ���Ƿ���̬������


 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͽ�1mol HһH����1mol NһH����1mol N��N ���ֱ���Ҫ��������Ϊ436kJ��391kJ��946kJ����H2��N2��Ӧ����0.5molNH3�� �������ա��ų��������� kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�У���������������ԭ�����͵���
A. ����ơ�ƺ�ƿ�����Ϸ��������ĭ
B. �����ڳ�ʪ�Ŀ�������������
C. ʵ�����г����ű���ʳ��ˮ�ķ����ռ�����
D. ��ҵ����������Ĺ�����ʹ�ù����Ŀ�������߶��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�������Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ���������Ϊȼ�ϵ�ص�ԭ�ϡ����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2)�ڴ����������ºϳɼ״�����������Ҫ��Ӧ����:
��CO(g)+2H2(g) ![]() CH3OH(g) ��H1 ����֪��CO�Ľṹ��N2���ƣ�
CH3OH(g) ��H1 ����֪��CO�Ľṹ��N2���ƣ�
��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)��H2
CH3OH(g)+H2O(g)��H2
��CO2(g)+H2(g) ![]() CO(g)+H2O(g) ��H3
CO(g)+H2O(g) ��H3
�ش���������:
(1)��֪��Ӧ������صĻ�ѧ��������������:
��ѧ�� | H-H | C-O | C=O | H-O | C-H |
E/(KJ/mol) | 436 | 343 | 1076 | 465 | 413 |
�ɴ˼�����H1=______kJ��mol-1����֪��H2=-58kJ��mol-1������H3=_____kJ��mol-1��
(2)��֪:
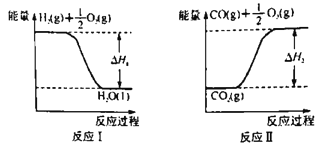
���״���ȼ����Ϊ��H3��������H1����H2����H3��ʾCO(g)+2H2(g) ![]() CH3OH(l)����H=________������H1=-285.8 kJ��mol-1����H2=+283.0 kJ��mol-1��ijH2��CO�Ļ��������ȫȼ��ʱ�ų�113.74 kJ������ͬʱ����3.6gҺ̬ˮ����ԭ���������H2��CO�����ʵ���֮��Ϊ______��
CH3OH(l)����H=________������H1=-285.8 kJ��mol-1����H2=+283.0 kJ��mol-1��ijH2��CO�Ļ��������ȫȼ��ʱ�ų�113.74 kJ������ͬʱ����3.6gҺ̬ˮ����ԭ���������H2��CO�����ʵ���֮��Ϊ______��
(3)��CH4��H2OΪԭ�ϣ�ͨ�����з�ӦҲ�����Ʊ��״���
��:CH4(g)+H2O(g)=CO(g)+3H2(g) ��H=+206.0 kJ��mol-1
��:CO(g)+2H2(g)= =CH3OH (g)��H=-129.0 kJ��mol-1
CH4(g)+H2O(g)��Ӧ����CH3OH(g)��H2(g)���Ȼ�ѧ����ʽΪ__________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤��øϴ�·۵�Ч����Ӧע��(����)
A. �÷�ˮ����ϴ�·�
B. �ú��Ƚϸߵ�����ˮ
C. ����ʱ������ˮ�ܽ�ϴ�·�
D. ������ϴ�Ӽ����ʹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ӦaA������+ B��������aC��g�������������ĸı�һ����ʹ��ѧ��Ӧ���ʼӿ���ǣ� ��
A.����A�����ʵ���B.������ϵ�¶�
C.����C�����ʵ���Ũ��D.������ϵ��ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2016�� ����ʡ���а�У�ڶ��������� ��������Ϊȼ�ϵ�����ȼ�ϵ�ؽṹʾ��ͼ��ͼ��ʾ�����ڸ���ص���������ȷ���ǣ� ��

A���õ���ܹ��ڸ����¹���
B����صĸ�����ӦΪ��C6H12O6��6H2O��24e����6CO2��24H+
C���ŵ�����У����ӣ�H+���Ӹ�������������Ǩ��
D���ڵ�ط�Ӧ�У�ÿ����1mol�����������������ɱ�״����CO2����22.4 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ΪC10H14�ı���ͬϵ���֪������ֻ��һ��ȡ����������˵����ȷ����
A. ���л��ﲻ�ܷ����ӳɷ�Ӧ�����ܷ���ȡ����Ӧ
B. ���л��ﲻ��ʹ���Ը��������Һ��ɫ������ʹ��ˮ��ɫ
C. ���л�������е�����ԭ�ӿ�����ͬһƽ����
D. ���л�����4�ֲ�ͬ�ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���õ�����(Si3N4)�մɴ���������췢���������Ȳ���,�ܴ������߷���������Ч�ʡ���ҵ���û�ѧ����������Ʊ�������ķ�Ӧ����:
3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g)����H<0
Si3N4(s)+12HCl(g)����H<0
һ���¶���,�����ܱ������н��и÷�Ӧ,���д�ʩ����������Ӧ�ķ�Ӧ���ʵ���(����)
A. ��������������� B. �����¶� C. ���뵪�� D. ���뺤��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com