
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2. N2的电子式为____________,该反应的方程式为___________________________________________
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为_________________(已知该反应为置换反应)
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为______,K的原子结构示意图为_______________________。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为______。
【答案】![]() 2Na3N == 6Na +N2 Fe 离子键和共价键
2Na3N == 6Na +N2 Fe 离子键和共价键 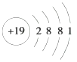 2NaHCO3
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
【解析】
(1)由8电子结构可知,N2分子中N原子之间形成3对共用电子对,其电子式为![]() ;
;
NaN3是气体发生剂,受热分解产生N2,根据氧化还原反应原理可知,另一生成物为钠,反应的化学方程式为2Na3N = 6Na +N2;
(2)Fe2O3是主氧化剂,与Na发生置换反应,Fe元素发生还原反应,则还原产物为Fe;
(3)KClO4由钾离子与高氯酸根离子构成,高氯酸根离子中Cl原子与O原子之间形成共价键,含有离子键、共价键;K是19号元素,其原子结构示意图为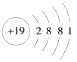 ;
;
(4)碳酸氢钠分解生成碳酸钠、二氧化碳与水,反应方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】某研究性学习小组为探究SO2的性质,设计如图所示实验装置(装置中的固定仪器和酒精灯均未画出):请回答下列问题:
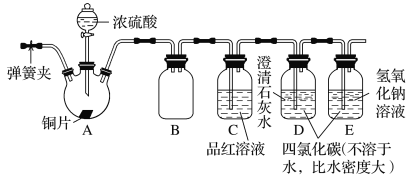
(1)B装置与D、E两装置中四氯化碳(CCl4)的作用相同,其作用是___。
(2)C装置中的现象是___,该现象证明SO2具有__性。
(3)若将C装置中的试剂换成酸性KMnO4溶液,发生反应的离子方程式为__,证明SO2具有__性。
(4)若将C装置中的试剂换成Na2S溶液,则现象为__,证明SO2具有___性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多巴胺是一种神经传导物质,在大脑内传递兴奋的信息,其分子结构如下所示。下列关于多巴胺的说法不正确的是

A. 分子式为C8H11NO2
B. 能与醛类物质发生缩聚反应
C. 既能与酸反应,又能与碱反应
D. 1mol该物质最多能与2mol Br2发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CAPE是蜂胶主要活性组分之一,具有抗炎、抗氧化和抗肿瘤的作用,在医学上具有广阔的应用前景。合成CAPE的路线设计如下:
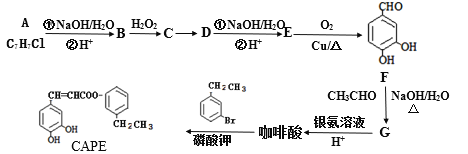
已知:①A的核磁共振氢谱有三个波峰,红外光谱显示咖啡酸分子中存在碳碳双键;
②  ;
;
③ 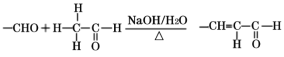 。
。
请回答下列问题:
(1) A中官能团的名称为____。
(2)C生成D所需试剂和条件是____。
(3)E生成F的反应类型为____。
(4)1mol CAPE与足量的NaOH溶液反应,最多消耗NaOH的物质的量为____。
(5)咖啡酸生成CAPE的化学方程式为____。
(6)芳香化合物X是G(C9H8O3)的同分异构体,满足下列条件,X的可能结构有____种,
a. 属于芳香族化合物
b. 能与饱和碳酸氢钠溶液反应放出CO2
c. 能与新制的 Cu(OH)2悬浊液反应生成砖红色沉淀
其中核磁共振氢谱显示有6种不同化学环境的氢,峰面积之比为1:2:2:1:1:1,写出一种符合要求的X的结构简式____。
(7)参照上述合成路线,以 ![]() 和丙醛为原料(其它试剂任选),设计制备
和丙醛为原料(其它试剂任选),设计制备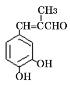 的合成路线____。
的合成路线____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题:
(1)向偏铝酸钠溶液中通入足量的CO2离子反应方程式____________;
(2)铝与氢氧化钠溶液化学反应方程式_____________;
(3)将饱和FeCl3溶液滴入沸水中制备氢氧化铁胶体化学反应方程式_________;
(4)向Al2(SO4)3溶液中滴加氨水制备氢氧化铝的离子反应方程式________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的原因的是
A. 铜久置空气中表面出现绿色固体:2Cu+O2+CO2+H2O═Cu2(OH)2CO3
B. 某种火箭发射阶段有少量N2O4,逸出,产生红色气体:N2O4![]() 2NO2
2NO2
C. FeSO4·7H2O在空气中久置变黄:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O
D. SO2通入KMnO4溶液中,溶液紫色逐渐褪去:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4十2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学设计实验制备CuBr(白色结晶性粉末,微溶于水,不溶于乙醇等有机溶剂),实验装置(夹持、加热仪器略)如图所示。
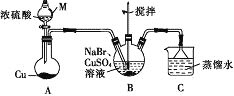
(1)仪器M的名称是________。
(2)若将M中的浓硫酸换成70%的H2SO4,则圆底烧瓶中的固体试剂为______(填化学式)。
(3)B中发生反应的化学方程式为_______,能说明B中反应已完成的依据是_____。若B中Cu2+仍未完全被还原,适宜加入的试剂是_______(填标号)。
a.液溴 b.Na2SO4 c.铁粉 d.Na2S2O3
(4)下列关于过滤的叙述不正确的是_______ (填标号)。
a.漏斗末端颈尖可以不紧靠烧杯壁
b.将滤纸润湿,使其紧贴漏斗内壁
c.滤纸边缘可以高出漏斗口
d.用玻璃棒在漏斗中轻轻搅动以加快过滤速率
(5)洗涤时,先用装置C中的吸收液清洗,其目的是_______,再依次用溶解SO2的乙醇、乙醚洗涤的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式正确的是
A. AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+
B. 碳酸的电离方程式:H2CO3![]() 2H++CO32-
2H++CO32-
C. 甲烷的标准燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
D. 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com