
分析 (1)N原子核外有7个电子,最外层有5个电子,根据构造原理顺序其价电子排布式;
(2)①根据价层电子对互斥理论确定分子空间构型;NH3分子含有1个孤电子对,NH3中N-H键之间的夹角为107°18′;②根据-H键与π键的关系式计算;
(3)同一主族元素中,氢化物的沸点随着相对分子质量的增大而增大,但含有氢键的氢化物的沸点较大.
解答 解:(1)氮原子的电子排布式1s22s22p3,其价层电子排布式为2s22p3,
故答案为:2s22p3;
(2)①NH3分子中氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥型,平面正三角形键角应该为120°,NH3分子含有1个孤电子对,孤电子对影响键角,其键角为107°18′,
故答案为:三角锥型;107°18′;NH3分子含有1个孤电子对,孤电子对影响键角;
②1mol氮气分子中含有2molπ键,若该反应中有4molN-H键断裂,即有1mol肼参加反应,生成1.5mol氮气,所以形成的π键有1.5mol×2=3mol,
故答案为:3;
(3)N元素非金属性较强,对应的氢化物含有氢键,沸点较高;在同主族元素对应的氢化物中AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3比PH3沸点高,则沸点大小为:NH3>AsH3>PH3,
故答案为:NH3>AsH3>PH3,NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3比PH3沸点高.
点评 本题考查了原子结构和性质,涉及价电子排布图、分子空间结构类型的判断、原子杂化方式的判断、氢键等知识点,这些都是考试热点,要重点掌握,该题难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
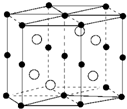
| A. | 锰价电子排布为3d74s0 | B. | Bi是d区金属 | ||
| C. | 该晶体的化学式为MnBi | D. | 该合金堆积方式是简单立方 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体在水中溶解时,只破坏分子间作用力 | |
| B. | 原子晶体中的各相邻原子都以非极性键相结合 | |
| C. | 分子晶体的熔沸点很低,常温下都呈液态或气态 | |
| D. | 含有金属阳离子的晶体不一定是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
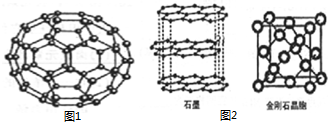 C60(结构模型如图1所示)的发现是化学界的大事之一.C60与金属钾化合生成K3C60具有超导性.
C60(结构模型如图1所示)的发现是化学界的大事之一.C60与金属钾化合生成K3C60具有超导性.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样,进行焰色反应 | |
| B. | 取样,滴加酚酞试液 | |
| C. | 取样,加入足量稀HNO3,再滴加AgNO3溶液 | |
| D. | 取样,加入足量BaCl2溶液,再滴加紫色石蕊试液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com