
【题目】根据下列五种短周期元素的电离能数据(单位:kJ/mol),回答下面各题。
元素代号 | I1 | I2 | I3 | I4 | I5 |
Q | 800.6 | 2427.1 | 3659.7 | 25025.8 | 32826.7 |
R | 495.8 | 4562 | 6910.3 | 9543 | 13354 |
S | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 |
T | 1402.3 | 2856 | 4578.1 | 7475.0 | 9444.9 |
U | 2080.7 | 3952.3 | 6122 | 9371 | 12177 |
(1)在这五种元素中,最可能处于同一族的两种元素是_________(填元素符号),S元素最可能是_____区元素
(2)基态Q元素原子的价电子排布式是____________。Q和T同周期。化合物QT中T元素的化合价为_______;第一电离能介于Q、T之间的同周期元素有______种。
(3)化合物RT3中化学键类型为_______,RT3的阴离子的几何构型为________。
(4)下列元素中,化学性质和物理性质最像U元素的是_____________
A.硼 B.铍 C.锂 D.氦 E.碳
(5)R的某种氧化物X晶胞结构如图所示,晶胞参数a=0.566 nm,X的化学式为_____;列式并计算晶体X的密度(g·cm-3)_____。

【答案】 B和Al p 2s22p1 -3 3 离子键、共价键 直线型 D Na2O ![]()
【解析】试题分析:本题考查电离能的分析和元素的推断,价电子排布式的书写,第一电离能大小的比较,离子几何构型的判断,晶胞的分析和计算。Q元素的I4![]() I3,Q元素的原子最外层有3个电子,Q处于IIIA;R元素的I2
I3,Q元素的原子最外层有3个电子,Q处于IIIA;R元素的I2![]() I1,R元素的原子最外层有1个电子,R处于IA;S元素的I4
I1,R元素的原子最外层有1个电子,R处于IA;S元素的I4![]() I3,S元素的原子最外层有3个电子,S处于IIIA;T、U元素的I1~I5没有突变,T、U的最外层电子数至少5个。
I3,S元素的原子最外层有3个电子,S处于IIIA;T、U元素的I1~I5没有突变,T、U的最外层电子数至少5个。
(1)根据上述分析,这五种元素中,最可能处于同一族的两种元素是Q和S,Q和S都处于IIIA,Q的I1大于S的I1,Q为B元素,S为Al元素。最可能处于同一族的两种元素是B和Al。S元素为Al元素,基态Al原子的核外电子排布式为1s22s22p63s23p1,最后一个电子填入3p能级,Al是p区元素。
(2)Q为B元素,B原子核外有5个电子,基态B原子核外电子排布式为1s22s22p1,基态B原子的价电子排布式为2s22p1。Q的化合价为+3价,根据化合物中元素的正负化合价代数和为0,QT中T元素的化合价为-3价。Q属于第二周期,Q和T同周期,T也属于第二周期,T为N元素,第一电离能介于B和N之间的有Be、C、O,共3种元素。
(3)R为IA族元素,R原子核外电子数大于5,R为Na元素;T为N元素,RT3为NaN3,其中含有离子键和共价键。NaN3中阴离子为N3-,N3-与CO2互为等电子体,CO2为直线型,则N3-也为直线型。
(4)U的最外层电子数至少5个,U不可能是IA族~IVA族元素,U的第一电离能较大,U可能是0族元素,化学性质和物理性质最像U元素的是氦,答案选D。
(5)用“均摊法”,小黑球(Na+):8个,大白球(O2-):8![]() +6
+6![]() =4,X的化学式为Na2O。晶胞的体积为(0.566nm)3=(0.566
=4,X的化学式为Na2O。晶胞的体积为(0.566nm)3=(0.566![]() 10-7)3cm3,1mol晶胞的体积为(0.566
10-7)3cm3,1mol晶胞的体积为(0.566![]() 10-7)3cm3
10-7)3cm3![]() NA,1mol晶胞的质量为4
NA,1mol晶胞的质量为4![]() 62g,晶体X的密度为
62g,晶体X的密度为![]() =2.27g/cm3。
=2.27g/cm3。


科目:高中化学 来源: 题型:
【题目】对化学反应的速率和限度的叙述正确的是( )
A.增加某一反应物的用量一定能够加快该反应的速率
B.化学反应的限度是不可改变的
C.化学反应进行的时间越长该反应的限度越大
D.化学反应达到限度时,正逆反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是( )
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105 Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性。下列叙述中不正确的是:
A. 红热的铜丝在氯气中剧烈燃烧,生成棕黄色烟
B. 钠在氯气中燃烧,生成白色的烟
C. 纯净的氢气在氯气中安静的燃烧,在集气瓶口形成白色烟雾
D. 氯气能与水反应生成盐酸和次氯酸,次氯酸见光易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗是重要的稀缺战略资源,广泛应用于众多国防军工及民用领域,属于我国战略收储金属。某科研课题采用的提取锗技术路线为:低品位锗精矿-(次亚磷酸钠热还原-真空挥发富集)-挥发产物高品位还原锗精矿-碱氧化预处理-盐酸蒸馏提纯-高纯四氯化锗-高纯二氧化锗。

(1)在周期表中金属与非金属的分界处,可以找到半导体材料,如Si、 等,半导体器件的研制正是开始于 ,后来发展到研制与它同族的 。三种元素依次是_______(填标号)。
a.Ge Si Ge
b.Ge Ge Si
c.C Si Ge
(2)请配平次亚磷酸钠热还原反应的化学方程式并在括号内注明反应条件:
___NaH2PO2·H2O+GeO2 ![]() ___Na4P2O7+___H2O+___GeO↑+___H3PO4,_____________
___Na4P2O7+___H2O+___GeO↑+___H3PO4,_____________
(3)高品位还原锗精矿碱氧化预处理过程的产物是锗酸钠,请写出该过程的化学反应方程式:____________________________________________
(4)高纯二氧化锗含量采用碘酸钾滴定法进行分析。称取3.600g高纯二氧化锗样品,采用氢氧化钠在电炉上溶样,次亚磷酸钠加热还原,然后以淀粉为指示剂,用碘酸钾标准溶液(0.6000mol/L)滴定,消耗的碘酸钾体积为19.00mL。[20℃以下,次亚磷酸钠不会被碘酸钾和碘氧化]
①滴定终点的现象是_____________________________。
②此样品中二氧化锗含量是_________。(保留四位有效数字)
(5)用氢气还原GeO2可制得金属锗。其反应如下:
GeO2+ H2= GeO+ H2O ①
GeO+ H2= Ge+ H2O ②
GeO2+ 2H2= Ge+ 2H2O ③
反应式③ΔH=+13750 kJ/mol ,ΔS=+15600J/(K·mol),则还原反应的温度一般控制在_________℃范围内。[已知GeO在700℃会升华,T(K)=t(℃)+273]
(6)锗在硝酸中的溶解速度受硝酸浓度、搅拌速度、温度等因素影响。如图,锗溶解速度有一最大值,硝酸的浓度小于此值时,随浓度增加溶解速度增加,反之降低,这是由于硝酸浓度高时_________加剧所致。
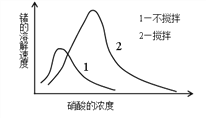
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内四种有机物的组成,请根据其生理功能分析回答:

(1)A是指____________;E在植物细胞内是指____________,在动物细胞内主要是指____________。
(2)F是指____________,其组成元素是____________。
(3)C的结构通式是____________,C形成G过程的反应叫____________。
(4)H是指____________,D是指____________。
(5)H和G共同组成细胞核内的重要物质____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com