
| A | B | C | D |
 |  |  |  |
| P代表的是压强 | c%是氨气百分含量 | 1molN2和3molH2反应达平衡放出热量92kJ | 平衡常数:Kb>Ka |
| A. | A | B. | B | C. | C | D. | D |
分析 A.合成氨增大压强平衡向正反应方向移动;
B.根据合成氨反应为放热反应,温度高平衡向逆反应方向移动;
C.根据合成氨为可逆反应,不可能反应到底分析;
D.温度高平衡向逆反应方向移动,所以温度越低平衡时氨气的量越多,平衡常数越大.
解答 解:A.合成氨增大压强平衡向正反应方向移动,所以平衡后正反应速率应大于逆反应速率,故A错误;
B.合成氨反应为放热反应,温度高平衡向逆反应方向移动,所以温度越高氨气百分含量越低,故B错误;
C.由图象可知 1molN2和3molH2完全反应放出热量92kJ,又合成氨为可逆反应,不可能反应到底,所以放出热量小于92kJ,故C错误;
D.因为温度高平衡向逆反应方向移动,所以温度越低平衡时氨气的量越多,平衡常数越大,所以平衡常数:Kb>Ka,故D正确;
故选D.
点评 本题以图象形式,考查化学反应中能量变化、化学平衡图象及影响因素等,难度中等.


科目:高中化学 来源: 题型:填空题
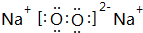 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2molSO2、0.1 molO2,1.8molSO3,达到新平衡时SO3转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | NaCl必须保存在棕色瓶中 | |
| D. | 含硫酸的废液倒入水槽,用水冲入下水道 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可经四步反应制取HOOCCH=CHCOOH.
可经四步反应制取HOOCCH=CHCOOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ | |
| B. | 钠与硫酸铜溶液反应:2Na+2Cu2+═2Na++Cu | |
| C. | Cl2通入NaOH溶液:Cl2+2OH-═Cl-+CLO-+H2O | |
| D. | 氧化铜溶于硫酸:O2-+2H+═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com