


科目:高中化学 来源:2011-2012学年辽宁省沈阳二中高一下学期期中考试化学试卷(带解析) 题型:实验题
(8分)用一定浓度的稀盐酸与稀NaOH溶液在左下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。已知强酸与强碱的中和热为57.3KJ/mol,水的比热容为4.2J/(g·℃),有关热量与比热容的计算公式:Q=m×c×△t(Q为热量,m为物质的质量,c为比热容,△t物质温度的变化值)
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是:
(2)将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。
下列叙述正确的是
| A.做该实验时环境温度为22 ℃ | B.该实验表明化学能可以转化为热能 |
| C.NaOH溶液的浓度约是1.00 mol/L | D.该实验表明有水生成的反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源:2015届安微省池州市高二上学期期中考试化学试卷试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具。下列化学用语错误的是 ( )
A.碳酸钠的水解反应:CO32-+H2O
 HCO3-+OH-
HCO3-+OH-
B.FeCl3水解的离子方程式:Fe3++3H2O Fe (OH)3+3H+
Fe (OH)3+3H+
C.稀溶液中强酸与强碱的中和热:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ· mol-1
D.C燃烧的热化学方程式为:C(s)+1/2O2(g)=CO(g) △H = 110.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014届江苏省启东市高二上学期期末考试化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语错误的是 ( )
A.碳酸钠的水解反应:CO32-+H2O
 HCO3-+OH-
HCO3-+OH-
B.FeCl3水解的离子方程式:Fe3++3H2O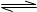 Fe (OH)3+3H+
Fe (OH)3+3H+
C.稀溶液中强酸与强碱的中和热:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ· mol-1
D.C燃烧的热化学方程式为:C(s)+1/2O2(g)=CO(g) △H = 110.5kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com