
工业废水中常含有一定量的Cr2O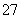 和CrO
和CrO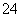 ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
CrO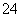
 Cr2O
Cr2O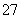
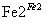 Cr3+
Cr3+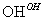 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:
2CrO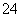 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O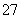 (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的 pH = 2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是________。
a.Cr2O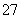 和CrO
和CrO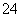 的浓度相同
的浓度相同
b.2v(Cr2O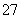 )=v(CrO
)=v(CrO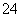 )
)
c.溶液的颜色不变
(3)第②步中,还原 1 mol Cr2O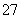 离子,需要________mol的FeSO4·7H2O。
离子,需要________mol的FeSO4·7H2O。
(4)第 ③步生成的Cr(OH)3 在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3 的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
方法2:电解法
该法用 Fe 做电极电解含Cr2O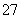 的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3 沉淀。
的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3 沉淀。
(5)用Fe做电极的原因为_____________________ _______________________。
_______________________。
(6)在阴极附近溶液 pH 升高的原因是(用电极反应解释)________,溶液中同时生成的沉淀还有________。
解析:本题主要结合工业废水的处理考查溶液中的平衡问题、氧化还原反应和电解原理的应用等知识,意在考查考生综合运用化学理论知识解决实际问题的能力。(1)pH=2 时,反应正向进行的速率较大,溶液呈橙色。(2)达到平衡状态时,正逆反应速率相等,混合物中各组分浓度保持不变,但不一定相等,溶液的颜色不再发生改变,即只有 c 正确。(3)根据反应前后 Cr 和 Fe 元素的化合价变化,可确定还原 1 mol Cr2O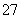 需 6 mol FeSO4·7H2O。(4)当 c(Cr3+)= 10-5 mol/L时,根据 Ksp 的表达式可求出 c(OH-)= 10-9 mol/L,则此时溶液 pH = 5。(5)用铁做阳极,反应中生成Fe2+,提供还原剂。(6)阴极 H+ 得电子生成 H2,随着电解的进行,溶液的 pH逐渐增大,溶液中还会生成 Fe(OH)3 沉淀。
需 6 mol FeSO4·7H2O。(4)当 c(Cr3+)= 10-5 mol/L时,根据 Ksp 的表达式可求出 c(OH-)= 10-9 mol/L,则此时溶液 pH = 5。(5)用铁做阳极,反应中生成Fe2+,提供还原剂。(6)阴极 H+ 得电子生成 H2,随着电解的进行,溶液的 pH逐渐增大,溶液中还会生成 Fe(OH)3 沉淀。
答案:(1)橙 (2)c (3)6 (4)5
(5)阳极反应为 Fe-2e-===Fe2+,提供还原剂Fe2+
(6)2H++2e-===H2↑ Fe(OH)3


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
在实验室进行物质制备,下列从原料及有关试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合 理的是
理的是
A.C CO
CO CO2
CO2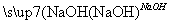 Na2CO3
Na2CO3
B.Cu Cu(NO3)2溶液
Cu(NO3)2溶液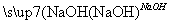 Cu(OH)2
Cu(OH)2
C.CaO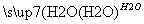 Ca(OH)2溶液
Ca(OH)2溶液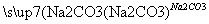 NaOH溶液
NaOH溶液
D.Fe Fe2O3
Fe2O3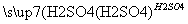 Fe2(SO4)3溶液
Fe2(SO4)3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下,AgBr的Ksp=4.9×10-13、AgI的Ksp=8.3×10-17。
(1)现向含有AgI的饱和溶液中:
①加入固体AgNO3,则c(I-)________(填“变大”、“变小”或“不变”,下同);
②若改加更多的AgI,则c(Ag+)________;
③若改加AgBr固体,则c(I-)____________________;而c(Ag+)________。
(2)有关难溶盐的溶度积及溶解度(与AgBr、AgI无关),有以下叙述,其中正确的是________。
A.两种难溶盐电解质,其中Ksp小的溶解度一定小
B.向含有AgCl固体的溶液中加入适量的水使AgCl溶解又达到平衡时,AgCl的溶度积不变,其溶解度也不变
C.将难溶 电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
D.溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先生成沉淀
E.难溶盐电解质的Ksp和温度有关
F.加入与原难溶电解质具有相同离子的物质,使难溶电解质的溶解度变小,也使Ksp变小
(3)现向含有NaBr、KI均为0.002 mol/L的溶液中加入等体积的浓度为4×10-3 mol/L AgNO3溶液,则产生的沉淀是________(填化学式);若向其中再加入适量的NaI固体,则最终可发生沉淀转化的总反应式表示为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH | ≥9.6 | ≥6.4 | 3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法错误的是( )
A.向该溶液中加入少量铁粉不能观察到红色固体析出
B.该溶液中c(SO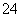 )∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4
)∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4
C.向该溶液中加入适量氯水,并调节pH到3~4后过滤,得到纯净的CuSO4溶液
D.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第________周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示]。
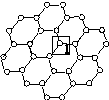

(a)石墨烯结构 (b)氧化石墨烯结构
(1)图(a)中,1号C与相邻C形成σ键的个数为________。
(2)图(b)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。
(3)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
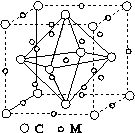
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为________,该能层具有的原子轨道数为______。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H22NH3实现储氢和输氢。下列说法正确的是________________________________________________________________________。
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH 与PH
与PH 、CH4、BH
、CH4、BH 、ClO
、ClO 互为等电子体
互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+中N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是________________________________________________________________________
________________________________________________________________________。
Ⅱ.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图G133所示:

图G133
(1)设氯化钠晶体中Na+与跟它最近邻的Cl-之间的距离为r,则该Na+与跟它次近邻的Cl-的个数为______,该Na+与跟它次近邻的Cl-之间的距离为______。
(2)已知在氯化钠晶体中Na+的半径为a pm,Cl-的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为________________________________________________________________________
(用含a、b的式子表示)。
(3)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在如图所示的有关物质转化关系中,各物质均是我们中学化学所学的物质。C为一种黑色粉末,D为一种气体。
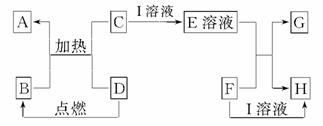
请根据框图中物质的转化关系及相关信息,用化学式填写下列空白:
(1)若F为可溶性碱,G为蓝色沉淀,则A为________,D可能为________。
(2)若G为蓝色沉淀,H为难溶性盐,则I为________。
(3)若G、H都属于盐,且G为蓝色溶液,则I可能为________,F可能为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com