
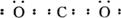
��ش��������⣺
(1)��XΪ�������ʣ�YΪ����ǽ������ʣ���ĵ���ʽΪ_________���ҵĻ�ѧʽΪ__________________��
(2)��X��Y��Ϊ�������ʣ���Ϊ��ɫ���壬��X���Ӧ�Ļ�ѧ����ʽΪ_________���䷴Ӧ����Ϊ_____________________________________________��
(3)��X��Y��Ϊ�ǽ������ʣ������¼�Ϊ��ɫҺ�壬д��X���Ӧʱ�Ļ�ѧ����ʽ___________________________
������Ҫ������Ԫ�ػ������֪ʶ����������ʽ��д������ʽ����д��Ԫ�ػ�������ۺ�����Ҫ��ϸߡ�
(1)![]() MgO
MgO
������X+��![]() ��+Y
��+Y
(��������) ���ʡ��ǽ�������
�÷�ӦΪ�û����ǽ�������Ϊ���峣��ΪC;����ΪMg��CO2��Ӧ
(2)8Al+3Fe3O4![]() 4Al2O3+9Fe �û���Ӧ
4Al2O3+9Fe �û���Ӧ
��������Ϊ��ɫ���壬�����Ƿ�ˮ��Һ�еķ�Ӧ�������ǽ����û�����������Al+Fe3O4���ȷ�Ӧ
(3)2F2+2H2O ====4HF+O2
��������Ϊ��ɫҺ�壬���Գ����³�������H2O��ˮ���û�ΪF2+H2O


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
| 1 |
| 2 |
| 3 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�� | �ṹ��������Ϣ |
| T | ԭ�ӵ�L����s����������p�������� |
| X | Ԫ�ص�ԭ�Ӱ뾶�ǵ�����������Ԫ�������ģ� |
| Y | �����к��䵥�ʣ�ԭ�ӵ������δ�ɶԵ������Ǹ�Ԫ���������������ģ� |
| Z | ���ʳ��¡���ѹ�������壮ԭ�ӵ�M������1��δ�ɶԵ�p���ӣ� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
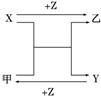 X��Y��Z����ѧ��ѧ�����ֳ���Ԫ�صĵ��ʣ��ס��������ֳ����Ļ�����������ͼת����ϵ��δע����Ӧ������������˵������ȷ���ǣ�������
X��Y��Z����ѧ��ѧ�����ֳ���Ԫ�صĵ��ʣ��ס��������ֳ����Ļ�����������ͼת����ϵ��δע����Ӧ������������˵������ȷ���ǣ�������| A����XΪ�������ʣ�YΪ�ǽ������嵥�ʣ���ZΪO2 | B����X��Y��Ϊ�������ʣ���ײ�����Ϊ��ɫ���� | C����XΪ�������ʣ�YΪ�ǽ������嵥�ʣ����ҿ���Ϊ��ɫ���� | D����X��Y��Ϊ�ǽ������嵥�ʣ���Z����ΪO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��X��Y��Z�У�ֻ��Y��ʹʪ��ĵ��۵⻯����ֽ���� | B��1mol Y��Z������ˮ��ȫ��Ӧʱ����ת��2mol���� | C��ZΪ���ӻ���������зǼ��Լ������������Ӹ�����Ϊ1��2 | D��X��Y�����������ſ���������ˮ���ռ� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com