
已知断裂1 mol C—H键,要吸收热量414.4 kJ;断裂1 mol C—C键,要吸收热量347.4 kJ;生成1 mol C===C键,会放出热量615.3 kJ;生成1 mol H—H键,会放出热量435.3 kJ,某有机物分解的反应可表示为:若在反应中消耗了1 mol乙烷,则有关该反应的说法正确的是( )A.该反应放出251.2 kJ的热量 B.该反应吸收251.2 kJ的热量
C.该反应放出125.6 kJ的热量 D.该反应吸收125.6 kJ的热量
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y原子最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )
A.元素X的简单气态氢化物的热稳定性比W弱
B.元素W的最高价氧化物对应水化物的酸性比Z的弱
C.化合物YX、ZX2、WX3中化学键类型相同
D.原子半径的大小顺序:rY>rZ>rW>rX
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,对于可逆反应X(g)+3Y(g) 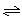 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是( )
A.c1∶c2=3∶1 B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率相等 D.c1的取值范围为0.04 mol/L<c1<0.14 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为研究铁粉与浓硫酸反应所生成气体的成份并测定各气体的含量,进行了如下实验:【实验推测】足量的铁粉与浓硫酸反应能生成SO2和H2两种气体。
(1)该小组作出此推测的理由是: 。
【实验准备】a.供选择的药品:铁粉、浓硫酸、氧化铜粉末、0.2 mol/L的H2C2O4标准溶液、0.1 mol/L的酸性KMnO4标准溶液、酸碱指示剂。
b.实验装置设计及组装(加热及夹持装置均已略去)
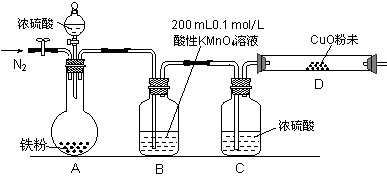 |
【实验过程及数据处理】
(2)B中发生反应的离子方程式为: 。
(3)实验前先通入一段时间的N2,其目的是 。
(4)B、C、D中所盛试剂均足量,则证实生成的气体中同时存在SO2和H2的现象是
。
(5)A中反应结束后,继续通N2使A中生成的气体全部赶出,待B、D中反应完全后,先后三次取用B中反应后的溶液于锥形瓶中,每次取用25 mL,用H2C2O4标准溶液进行测定。
①H2C2O4标准溶液与酸性KMnO4溶液反应的离子方程式如下,请将该方程式完成并配平。
( )H2C2O4+( )MnO4- +( )H+ =( )Mn2+ +( ) H2O+( ) ( )
②反应完全的现象是 。
③重复测定两次,平均每次耗用H2C2O4标准溶液15.63 mL,则铁与浓硫酸反应产生的SO2气体
的物质的量为 ;经称量,实验前后装置D的质量减少0.8 g,则产生的气体中SO2的体积分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能获得成功的是( )
①甲烷气体通入空气中点燃获得热量
②甲烷气体通入氯水中制取一氯甲烷
③甲烷通入高锰酸钾酸性溶液,可使紫色褪去
④甲烷通入浓硝酸中分解得到碳单质和氢气
A.只有①② B.只有①
C.只有④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的说法错误的是( )
A.热稳定性:HCl>HI B.原子半径:Na>Mg
C.酸性: H2SO3>H2SO4 D.结合质子能力:S2->Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
两种气态烷烃的混合物,在标准状况下其密度为1.03 g·L-1 ,则关于该混合物组
成的说法正确的是
A.一定有甲烷 B.一定有乙烷
C.不可能是甲烷和乙烷的混合物 D.可能是乙烷和丙烷的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com