
【题目】两份质量相等的SO2和SO3,下列说法正确的是( )
A. 氧原子的物质的量之比是1:1
B. 硫原子的物质的量之比是5:4
C. 氧元素的质量之比是3:2
D. 硫元素的质量之比是1:1
 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )

A. 该反应的化学方程式为:3X+2Y![]() 2Z
2Z
B. 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0
C. 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D. 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量Mg与100mL4mol/L的盐酸反应,固体全部溶解后再加入2mol/L的NaOH溶液,生成沉淀最多时至少需加入氢氧化钠溶液体积为
A. 200mL B. 250mL C. 300mL D. 400mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式或离子方程式(若是离子反应,则写出离子方程式,若不是离子反应,则写出化学方程式)。
(1)铝和氢氧化钠溶液反应:_____________;
(2)实验室制氯气: _____________;
(3)实验室制氨气: _____________;
(4)铜和浓硝酸反应: _____________;
(5)二氧化硫催化氧化: _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一些常见单质、化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质,G、J的焰色均为黄色。反应①为炼铁高炉中的重要反应;反应②可用于焊接铁轨。
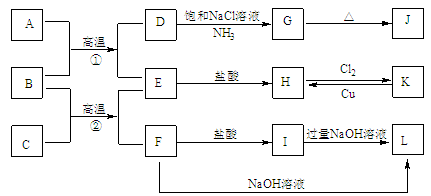
请回答下列问题:
(1)B的化学式为 ,J的化学式为 。
(2)工业上将氯气通入石灰乳中制取漂白粉,该反应的化学反应方程式为 。
(3)D→G是侯氏制碱法的主要反应,该反应的化学方程式为 。
(4)K→H是制作印刷电路板的重要反应,该反应的离子方程式为 。
(5)F→L是铝土矿提纯中的重要反应,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
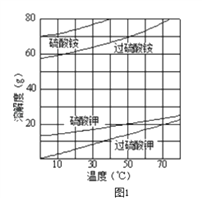
【题目】过硫酸钾(![]() )具有强氧化性(常被还原为硫酸钾),80℃以上易发生分解.实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80℃以上易发生分解.实验室模拟工业合成过硫酸钾的流程如下:
(1)硫酸铵和硫酸配制成电解液,以铂作电极进行电解,生成过硫酸铵溶液.写出电解时发生反应的离子方程式________________________.
(2)已知相关物质的溶解度曲线如图1所示.在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中,__________________________,干燥.
(3)样品中过硫酸钾的含量可用碘量法进行测定.实验步骤如下:
步骤1:称取过硫酸钾样品0.3000g于碘量瓶中,加入30mL水溶解.
步骤2:向溶液中加入4.000g KI固体(略过量),摇匀,在暗处放置30min.
步骤3:在碘量瓶中加入适量醋酸溶液酸化,以淀粉溶液作指示剂,用0.1000molL﹣1 Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液21.00mL.(已知反应:I2+2S2O32﹣=2I﹣+S4O62﹣)
①若步骤2中未将碘量瓶“在暗处放置30min”,立即进行步骤3,则测定的结果可能_______(选填“偏大”、“偏小”、“无影响”);上述步骤3中滴定终点的现象是_________.
②根据上述步骤可计算出该样品中过硫酸钾的质量分数为_______.
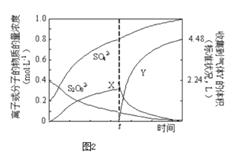
(4)将0.40mol过硫酸钾与0.20mol硫酸配制成1L溶液,在80℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如图2所示(H+浓度未画出).图中物质X的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作:①取液体试剂,②取固体试剂,③溶解,④过滤,⑤蒸发。一定要用到玻璃棒的是
A. ①②③ B. ②③④ C. ①②⑤ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下,有两瓶体积相等的CO和CO2,这两种气体中所含的分子数目之比为___,所含的原子总数目之比为___,质量比为___,密度之比为___。
(2)在Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O反应中,
CuSO4+ SO2↑+ 2H2O反应中,
①______元素被氧化,_______是氧化剂。
②用双线桥标出该反应电子转移的方向和数目。
Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O
CuSO4+ SO2↑+ 2H2O
③若有2.4mol的H2SO4参与反应,则被还原的H2SO4为___g,生成标况下的二氧化硫气体_______ L,转移电子的数目为_______________。(NA表示阿伏加德罗常数的值)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com