
【题目】现有化合物:
甲: 乙:
乙: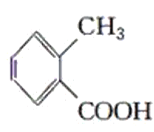 丙:
丙: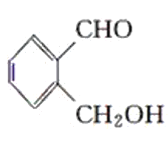
(1)请判别上述哪些化合物互为同分异构体(填序号):____________。
(2)请用一种试剂鉴别甲、乙、丙化合物。在下表中填入所选试剂及主要现象即可。________
试剂 | 现象 | |
甲 | ||
乙 | ||
丙 |
【答案】乙丙
试剂 | 现象 | |
甲 | 新制Cu(OH)2悬浊液 | 分层 |
乙 | Cu(OH)2溶解,溶液变为蓝色,沉淀消失 | |
丙 | 砖红色沉淀 |
【解析】
(1)结合同分异构体的定义判断;
(2)甲是苯的同系物,B中含-COOH,丙中含-CHO,结合苯、羧酸、醛的性质鉴别。
(1)分子式相同而结构不同的有机物互称为同分异构体,乙、丙两种物质的分子式都为C8H8O2,但结构不同,故乙丙互为同分异构体;
(2)甲是甲苯,能使酸性高锰酸钾溶液褪色;乙中含有羧基,显酸性,与碳酸氢钠溶液作用有气泡生成,能溶解氢氧化铜;丙中含有醛基,与银氨溶液共热发生银镜反应,如加入氢氧化铜浊液,则生成砖红色沉淀,故表格答案为:
试剂 | 现象 | |
甲 | 新制Cu(OH)2悬浊液 | 分层 |
乙 | Cu(OH)2溶解,溶液变为蓝色,沉淀消失 | |
丙 | 砖红色沉淀 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1mL稀释至100mL后,pH=3
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为1×10﹣12
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法错误的是
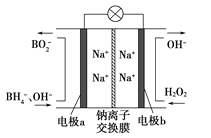
A. 电池放电时Na+从a极区移向b极区
B. 电极b采用MnO2,MnO2既作电极材料又有催化作用
C. 该电池的负极反应为:BH4-+8OH――8e-=BO2-+6H2O
D. 每消耗3molH2O2,转移的电子为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用6mol·L-1的硫酸配制100mL1mol·L-1硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.20mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)实验时应选用仪器的先后顺序是(填入编号)__。
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)__。
A.使用容量瓶前检查它是否漏水B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm~3cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近容量瓶刻度标线1cm~2cm处,用滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是( )
A.100mL 12mol·L-1的浓硝酸与过量铜反应转移的电子数为0.6 NA
B.标准状况下,5.6L四氯化碳含有的分子数为0.25 NA
C.等物质的量的水与重水含有相同的质子数
D.3.4g氨气中含有的N-H键数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。

(1)该反应是____________________反应(填“吸热”、“放热”)。
(2)反应体系中加入催化剂对反应热是否有影响?_______________,原因是_________.
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香族化合物A的水溶液呈酸性,测得A分子中无酚羟基。A可发生下图所示转化,其中F为五元环状化合物;G可使溴的四氯化碳溶液褪色;F和G互为同分异构体;H和I都是医用高分子材料。

请回答:
(1)E中的官能团名称是羟基、 。
(2)③的反应类型是 。
(3)②的化学方程式是 。
(4)A与H的结构简式分别是 、 。
(5)D与足量X溶液反应后可得到C7H5O3Na,则X溶液中所含溶质的化学式是 。
(6)符合下列条件的G的同分异构体中有一种具有反式结构.该反式结构是 (用结构简式表示)。
①能发生水解反应
②分子中不含环状结构
③核磁共振氢谱显示分子中有4种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10mL0.40molL-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6min时,c(H2O2)=0.30mol·L-1
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年为门捷列夫发现元素周期律150周年。门捷列夫预言了很多未知元素,锗是其中一种,工业上用精硫锗矿(主要成分为GeS2)制取高纯度锗,其工艺流程如图所示:
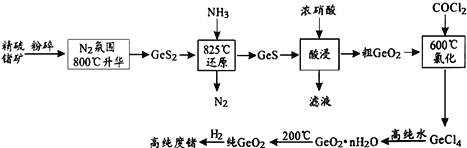
(1)开始将精硫锗矿粉碎的目的是_______。工艺流程中COCl2分子中各原子均达到8电子稳定结构,其结构式为_______。
(2)酸浸时温度不能过高的原因是______(用化学方程式表示)。
(3)GeCl4易水解生成GeO2·nH2O,此过程化学方程式为___________。温度对GeCl4水解率的影响如图所示,为提高水解率,实验时可采取的措施为______(填序号)。
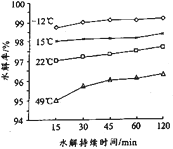
A.冰水溶 B.冰盐水浴 C.49℃水浴
(4)GeO2是锗酸(H2GeO3)的酸酐。请通过计算判断25℃时0.1mol·L—1的 NaHGeO2溶液pH________(填“>”=”或“<”)7,理由是__________。(已知25℃时,H2GeO2的![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com