
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
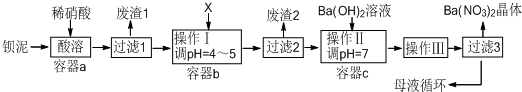
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用铜丝或铁丝代替铂丝 | |
| B. | 用固体样品或配成的溶液进行实验,现象相同 | |
| C. | 每次实验前,铂丝要先用硫酸洗涤 | |
| D. | 焰色反应实验所用火焰,无论何种燃料均可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1780 | B. | 1220 | C. | -1220 | D. | -1780 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
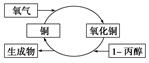
| A. | 1丙醇发生了还原反应 | |
| B. | 生成物可以发生银镜反应 | |
| C. | 反应中有红黑颜色交替变化的现象 | |
| D. | 2丙醇也能发生图示的催化氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水中的溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3 | |
| C. | 相同条件下与同浓度的盐酸反应产生气体的速率:Na2CO3>NaHCO3 | |
| D. | 物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应生成的CO2的量:Na2CO3=NaHCO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:填空题
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_____________________。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=_____________
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+ O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
C(s)+ O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJ•mol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____________。
(4)如图是N2和H2反应生成2molNH3过程中能量变化示意图:

①请计算每生成1molNH3放出热量为:_________.
②若起始时向容器内放入1molN2和3molH2达平衡后N2的为20%,则反应放出的热量为Q1kJ,则Q1的数值为_________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com