
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
���� ��1����������Һ��pHֵΪ1����Һ��������Ũ��Ϊ1��10-1mol•L-1��˵�������ӹ�������������ϡ���������������Һ�����ʽ�����V1��V2�ı�ֵ��
��A������Ӧ����Һ�����ԣ���c��H+��=c��OH-��=1��10-7mol/L��
B����V1=V2����Ӧ����ҺpH����7��С��7��
C������Ӧ����Һ�����ԣ�V1���ܵ���V2��
D�������Һ�ʼ��ԣ�����Һ�����Ǽ������Һ��Ҳ����ֻ������Һ��
��2������ͬŨ�ȵ�������Һ���������Խ�������������ˮ��̶�Խ����������ҺpHȷ�����ǿ������ͬŨ�ȵIJ�ͬ�ᣬ��ˮϡ�ʹٽ�������룬��ϡ����ͬ�ı������������Խ��������Һϡ������pH�仯ԽС��
���������ˮ��̶�Խǿ�����������Խ�������ǿ����ȡ���������
��3�����ʱ��������Ǧ����ʧ���Ӻ�ˮ��Ӧ���ɶ�����Ǧ��
��� �⣺��1������Һ���������Ƶ����ʵ���Ϊ��V2��10-3L��0.1mol/L=V2��10-4mol��
ϡ��������ʵ���Ϊ��V1��10-3L��0.15mol/L��2=3V1��10-4mol��
����Һ��Ϻ���Һ��ʾ���ԣ�������Ũ��Ϊ1��10-1mol•L-1��
���У�3V1��10-4mol-V2��10-4mol=��V1+V2����10-3L��1��10-1mol•L-1=��V1+V2����10-4mol��
���V1��V2=1��1��
�ʴ�Ϊ��1��1��
��A���������Һ�����ԣ�����Һ��c��H+��=c��OH-��=2��10-7 mol•L-1��������Һ��c��H+��+c��OH-��=2��10-7 mol•L-1������ȷ��
B��������������ȣ��������ǿ�ᣬ������Һ�����ԣ�����������ᣬ������Һ�����ԣ��ʴ���
C�������Һ�����ԣ�����Һ���������Һ���������ᣬ��Ũ�ȴ�����������Ũ�ȣ�����V1��һ������V2���ʴ���
D�������Һ�ʼ��ԣ�����Һ�����Ǽ������Һ��Ҳ����ֻ������Һ����V1һ��С��V2������ȷ��
��ѡAD��
��2������ͬŨ�ȵ�������Һ���������Խ�������������ˮ��̶�Խ����������ҺpHȷ�����ǿ������ͬŨ�ȵIJ�ͬ�ᣬ��ˮϡ�ʹٽ�������룬��ϡ����ͬ�ı������������Խ��������Һϡ������pH�仯ԽС������������Һ��pH֪��HCN��HClO��CH3COOH��H2CO3����������Դ�С˳����CH3COOH��H2CO3��HClO��HCN��������Һ��pH�仯��С����HCN����ѡA��
��HCN��HClO��CH3COOH��H2CO3����������Դ�С˳����CH3COOH��H2CO3��HClO��HCN������ǿ����ȡ����֪��
A������CH3COOH��H2CO3��HCO3-�����Զ��߷�ӦΪCH3COOH+Na2CO3�TNaHCO3+CH3COONa������ȷ��
B���������Դ���HCN�����Զ��߷�ӦΪCH3COOH+NaCN�TCH3COONa+HCN������ȷ��
C��̼�����Դ��ڴ����ᣬ���Զ��߷�ӦΪCO2+H2O+NaClO�TNaHCO3+NaClO���ʴ���
D������H2CO3��HClO��HCN������NaHCO3��HCN���߲���Ӧ���ʴ���
��ѡAB��
��3�����ʱ��������Ǧ����ʧ���Ӻ�ˮ��Ӧ���ɶ�����Ǧ���缫��ӦʽΪPb2++2H2O-2e-=PbO2��+4H+��������Cu2+�ŵ磺Cu2++2e-=Cu������������ͭ������������ʯī�ϰ���ͭ�Ʋ㣻����Cu��NO3��2���������Ϸŵ����Cu2+��������Pb2+�������ŵ磬�Ӷ�ȷ��Pb2+�������ŵ���������Ǧ�����Pb2+�������ʣ�
�ʴ�Ϊ��Pb2++2H2O-2e-�TPbO2+4H+��ʯī�ϰ���ͭ�Ʋ㣬���Pb2+�������ʣ�
���� ���⿼��̼��Ԫ�����ʣ��漰���ʵ������йؼ��㡢���ӷ�Ӧ�����ԭ����֪ʶ�㣬ע�⣨3���������������缫��Ӧʽ����д��Ϊ�״��㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
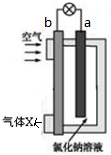
| A�� | ����һ��ʱ���c��Na+����� | |
| B�� | ��ع���ʱ��OH-��a���ƶ� | |
| C�� | ����X ��N2�İٷֺ����������ͬ | |
| D�� | ����ܷ�ӦΪ2Mg+O2+2H2O�T2 Mg��OH��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����кͷ�Ӧ | B�� | �������������������ֽ� | ||
| C�� | Ba��OH��2•8H2O��NH4Cl��Ӧ | D�� | п����ϡH2SO4��Ӧ��ȡH2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 һ��������þ���������Ͷ��2mol•L-1�������У���������ȫ�ܽ������Һ�м���2mol•L-1������������Һ�����ɳ������������������������Һ�������ϵ��ͼ��ʾ����
һ��������þ���������Ͷ��2mol•L-1�������У���������ȫ�ܽ������Һ�м���2mol•L-1������������Һ�����ɳ������������������������Һ�������ϵ��ͼ��ʾ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2ʹƷ����Һ��ɫ��Cl2ʹƷ����Һ��ɫ��ԭ����ͬ | |
| B�� | ������ɫ��Ӧ���Լ���KCl��NaCl | |
| C�� | ���ó���ʯ��ˮ���Լ���NaHCO3��Һ��Na2CO3��Һ | |
| D�� | ��AgNO3��Һ��ϡ������Լ���KCl��K2CO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1mol•L-1 | B�� | 0.2mol•L-1 | C�� | 0.3mol•L-1 | D�� | 0.4mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
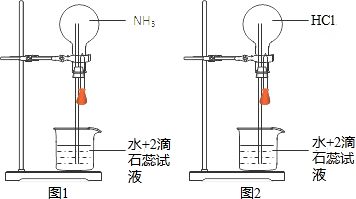
| A�� | ������Һ�����ʵ����ʵ���Ũ�Ⱦ�Ϊ$\frac{1}{{V}_{m}}$mol•L-1 | |
| B�� | ����Ȫ������ʱ��ƿ�ڳ���Һ�� | |
| C�� | ͼ2��ͨ�����ͷ���������Ȫ�� | |
| D�� | ͼ1��ͼ2����Ȫ����ɫ�ֱ�Ϊ��ɫ����ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1 mol•L-1��NaHCO3��Һ�У�c��OH-��=c��H+��+c��HCO3-��+2c��H2CO3�� | |
| B�� | �����ʵ���Ũ�ȵ�������Һ���٣�NH4��2SO4����NH4Cl����NH3•H2O�У�c��NH4+���Ĵ�С˳��Ϊ���ۣ��ڣ��� | |
| C�� | 25��ʱ��pH=4��KHC2O4��Һ�У�c��HC2O4-����c��H2C2O4����c��C2O22-�� | |
| D�� | CH3COONa��Һ�������ϳ����Ե���Һ�У�c��Na+����c��Cl-��=c��CH3COOH�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4�� | B�� | 5�� | C�� | 6�� | D�� | 7�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com