
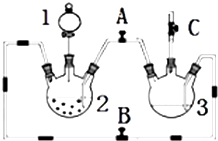
 某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用如图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁屑、稀硫酸、氢氧化钠溶液.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
分析 用右图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液,结合装置分析可知,开启BC,关闭A,需要在三颈瓶2中加入铁单质,分液漏斗中是稀硫酸,利用反应生成氢气排净装置中的空气,可以收集C处的气体检验是否是纯净的氢气,将仪器中的空气排尽后,然后关闭B,开启AC,利用生成的氢气在装置2中压强增大,把硫酸亚铁溶液压入装置3的氢氧化钠溶液中,反应生成白色氢氧化亚铁白色沉淀,可观察到氢氧化亚铁的颜色为白色沉淀,
(1)分析可知分液漏斗中为稀硫酸,和装置2中的铁反应生成硫酸亚铁和氢气;
(2)结合装置分析可知,开启BC,关闭A,需要在三颈瓶2中加入铁单质,分液漏斗中是稀硫酸,利用反应生成氢气排净装置中的空气,可以收集C处的气体检验是否是纯净的氢气,将仪器中的空气排尽后,然后关闭B,开启AC,利用生成的氢气在装置2中压强增大,把硫酸亚铁溶液压入装置3的氢氧化钠溶液中,反应生成白色氢氧化亚铁白色沉淀,防止生成的氢氧化亚铁被空气中的氧气氧化;
(3)将铁粉换成铁块或铁钉,可以防止仪器2中铁粉通过导管进入仪器3中;
(4)①依据该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇分析,洗涤不能溶解产品,不能引入新的杂质;
②称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定,发生的反应为高锰酸钾溶液氧化亚铁离子为铁离子;
反应终点的判断可以利用高锰酸钾溶液的紫红色判断,滴入最后一滴溶液变化为紫红色,半分钟内不变,证明反应达到终点;
依据反应的定量关系计算亚铁离子物质的量,得到(NH4)2SO4•FeSO4•6H2O的质量,计算纯度,高锰酸钾溶液的体积第一次误差较大,应舍去;
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积,液面被提高,读取体积减小;
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡测定溶液体积增大;
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,待装液润洗会增多消耗高锰酸钾溶液的体积,测定结果增大;
D.三次使用的高锰酸钾都是一样的,消耗的高锰酸钾体积应是相同的.
解答 解:(1)此实验目的是制备氢氧化亚铁,先用铁和稀硫酸反应制备硫酸亚铁,此反应在装置2中进行,稀硫酸是溶液,应盛放在分液漏斗中,即应盛放在1处D的分液漏斗中,
故答案为:分液漏斗;
(2)打开B、C,关闭A,利用装置2中产生的氢气,把装置3中的空气排尽,使装置处于还原氛围,然后关闭B,打开A,产生气体压强增大,把产生的FeSO4,压入到装置3中,产生白色沉淀Fe(OH)2,氢氧化亚铁溶液被空气中的氧气所氧化,生成氢氧化铁,对氢氧化亚铁颜色的观察产生干扰,所以要排除装置中的空气,防止生成的氢氧化亚铁被氧化,
故答案为:B;AC;白色;防止生成的氢氧化亚铁被氧化;
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是,将铁粉换成铁块或铁钉,可以防止仪器2中铁粉通过导管进入仪器3中,
故答案为:将铁粉换成铁块或铁钉;
(4)①因为硫酸亚铁铵易溶于水,不溶于乙醇,应该用乙醇洗涤,减少硫酸亚铁铵的溶解,同时利用乙醇和水互溶,从而达到洗涤的要求,故选D,
故答案为:D;
②利用高锰酸钾的强氧化性,Fe2+的强还原性,两者发生氧化还原反应,Fe2+被氧化成Fe3+↑1,Mn由+7价→+2↓5,最小公倍数5,根据原子个数、电荷守恒,即MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,向溶液中滴加中高锰酸钾,高锰酸钾显紫红色,因此滴定到终点:最后一滴滴入,溶液由无色变为浅紫色,且30s不变色,因为第一次与第二次、第三次相差较大,忽略不计,消耗高锰酸钾溶液的体积为 $\frac{25.02+24.98}{2}$ml=25mL,根据离子反应方程式,得出:n[(NH4)2SO4•FeSO4•6H2O]=5n(KMnO4)=25×10-3×c×5mol,则500mL溶液中含有n[(NH4)2SO4•FeSO4•6H2O]=25×10-3×c×5×500/25mol=2.5cmol,
所以质量分数=2.5c×$\frac{392}{a}$×100%=$\frac{980c}{a}$×100%,
A、俯视读数,造成所读的数偏小,故A错误;
B、滴定管尖嘴有气泡,滴定结束无气泡,所消耗的液体体积增加,故B正确;
C、锥形瓶用待测液润洗,待测液的物质的量增加,则消耗高锰酸钾的体积增加,故C正确;
D、三次使用的高锰酸钾都是一样的,消耗的高锰酸钾体积应是相同的,故D错误.
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;最后一滴滴入,溶液由无色变为浅紫色,且30s不变色;$\frac{980c}{a}$×100%;BC.
点评 本题考查了氢氧化亚铁制备的非常规制备方法和实验过程分析判断,滴定实验的注意问题和计算应用,注意掌握物质性质,实验过程的理解应用,掌握基础是解题关键,题目难度中等.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 聚丙烯的结构简式为: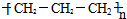 | |
| B. | 已知:正丁烷(C4H10)的二氯代物有六种同分异构体,则它的八氯代物也有六种同分异构体 | |
| C. | 四氯化碳分子的电子式为: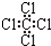 | |
| D. | 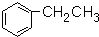 有7种吸收峰 有7种吸收峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 1:3:2 | C. | 2:4:5 | D. | 2:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | C | D | F | |||||
| 三 | B | E | G | R | ||||
| 四 | A | H |
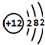 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | |
| C(s) | H2O(g) | H2(g) | |||
| 甲 | 2 | T1 | 2 | 4 | 3.2 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增小 | |
| C. | N、O、F原子半径依次增大 | |
| D. | Na、K、Rb的电子层数依次增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | ||||||
| 3 | D | E | F | G | H | I | ||
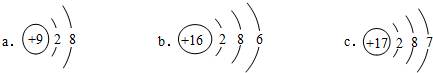
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com