
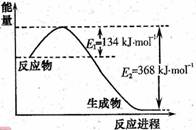
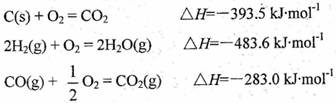
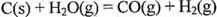 ���ʱ�Ϊ ��
���ʱ�Ϊ ��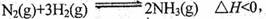 �仯ѧƽ�ⳣ��K��t�Ĺ�ϵ���±���
�仯ѧƽ�ⳣ��K��t�Ĺ�ϵ���±���
| A��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2 |
| B��2v(��)��N2��=v(��)��H2�� |
| C��������ѹǿ���ֲ��� |
| D�����������ܶȱ��ֲ��� |
 ��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ת��Ϊ�����������仯 |
| B������ͬ�����º��ױȰ����ȶ� |
| C����ͬ������,���������е��������Ȱ��ĸ� |
| D����ͬ�����ĺ��Ͱ�����ȫȼ�շų���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
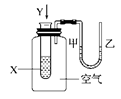
| A���٢ڢ� | B���٢� | C���٢� | D���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ָ���³�ѹ�£�2������Ӻ�1�������ӷ�Ӧ����2��ˮ���ӣ��ų�����571.6 kJ |
| B����ָ���³�ѹ�£�2 mol H2(g)��1 mol O2(g)��Ӧ����2 mol H2O(l)���ų�����571.6 kJ |
| C����ָ��״���£�2 mol H2O(l)�ֽ�Ϊ2 mol H2(g)��1 mol O2(g)����������571.6 kJ |
| D����ָ���³�ѹ�£�2 mol H2(g)��1 mol O2(g)��Ӧ����2 mol H2O(g)���ų�����571.6 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
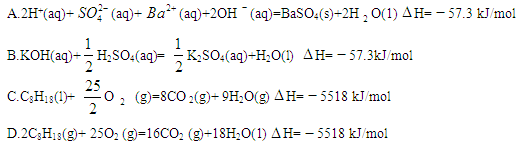
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��NaOH��aq����HCl��aq����NaCl��aq����H2O��l������H����28.7kJ/mol |
| B��NaOH��aq����HCl��aq����NaCl��aq����H2O��l������H����28.7kJ/mol |
| C��NaOH��aq����HCl��aq����NaCl��aq����H2O��l������H����57.4kJ/mol |
| D��NaOH��aq����HCl��aq����NaCl��aq����H2O��l������H����57.4kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢ܢݢ� | B���ڢۢ� | C���٢ڢܢ� | D���ڢܢޢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3����H=��196.6kJ/mol
2SO3����H=��196.6kJ/mol ��C(s) + O2(g) ="=" CO2(g)����H=" +393.5kJ/mol"
��C(s) + O2(g) ="=" CO2(g)����H=" +393.5kJ/mol" �鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com