
| 粒子 | A+ | B2- | C | D | E | F |
| 组成特点 | 单核离子 | 化合物, 双核分子 | 单质, 双核分子 | 化合物, 三核分子 | 化合物, 四核分子 | |
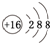 .
.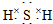 ;F的水溶液常用于消毒剂,F的化学式是H2O2.
;F的水溶液常用于消毒剂,F的化学式是H2O2. 分析 18e-微粒来源大体分三个部分:一是第三周期元素的气态氢化物及去H+的对应离子,二是第四周期的金属阳离子,三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子K+、Ca2+;阴离子P3-、S2-、HS-、Cl-;分子有Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4等,结合题目所给条件解答.
(1)阳离子中,原子序数=核外电子数+电荷数=核内质子数,阴离子中,原子序数=核外电子数-电荷数=核内质子数,含有18e-的A+、B2-、分别为K+、S2-,据此书写B2-的结构示意图;
(2)单质,双核分子为F2,氧化能力最强,化合物,双核分子有HCl,氟气和氯化氢发生置换反应;
(3)由两种元素组成的三原子分子为H2S,硫化氢为共价化合物,根据共价化合物的电子式表示方法书写,F为四核分子,水溶液常用于消毒剂为H2O2.
解答 解:18e-微粒来源大体分三个部分:一是第三周期元素的气态氢化物及去H+的对应离子,二是第四周期的金属阳离子,三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子K+、Ca2+;阴离子P3-、S2-、HS-、Cl-;分子有Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4等,
(1)含有18e-的A+、B2-、分别为K+、S2-,所以A元素为K,B元素为S,S2-的结构示意图为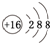 ,
,
故答案为:K;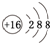 ;
;
(2)18e-微粒,为单质双核分子,所以$\frac{18}{2}$=9,为F2,氧化能力最强,化合物,双核分子有HCl,氟气和氯化氢发生置换反应F2+2HCl═2HF+Cl2,
故答案为:F2+2HCl═2HF+Cl2;
(3)由两种元素组成的三原子分子为H2S,硫化氢为共价化合物,分子中存在两个H-S键,电子式为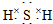 ,含有18e-的过氧化氢为常用的消毒剂,所以F为四核分子,水溶液常用于消毒剂为H2O2,
,含有18e-的过氧化氢为常用的消毒剂,所以F为四核分子,水溶液常用于消毒剂为H2O2,
故答案为: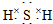 ;H2O2;
;H2O2;
点评 本题考查18电子微粒的结构和性质,题目难度不大,注意原子、离子中核外电子数与原子序数及核内质子数之间的关系是解答关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Mg2+>O2->F- | B. | 原子半径:Na>S>O | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 酸性:HClO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH均为9的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液,其物质的量浓度的大小顺序为①>②>③ | |
| B. | 等物质的量浓度的Na2CO3溶液和NaHCO3溶液等体积混合,所得溶液中:c(CO32-)+c(OH-)<c(H+)+c(HCO3-)+3c(H2CO3) | |
| C. | 0.1 mol•L-1KHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)-2c(C2O42-) | |
| D. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其气态氢化物溶于水显碱性.(填“酸”或“碱”)
,其气态氢化物溶于水显碱性.(填“酸”或“碱”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3═NH3↑+CO2↑+H2O | B. | NH3+HCl=NH4Cl | ||
| C. | 2KOH+Cl2=KCl+KClO+H2O | D. | 2K2O2+2CO2=2K2CO3+O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com