
【题目】在密闭容器中进行如下反应:2SO2(g) +O2(g) ![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达平衡时,可能存在的数据是
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达平衡时,可能存在的数据是
A. SO2为0.4mol/L
B. SO2为 0.25mol/L
C. SO2、SO3均为0.15mol/L
D. SO3为0.4mol/L
【答案】B
【解析】
该反应为可逆反应,若该反应从正反应方向开始,SO2、O2、SO3的浓度分别为0.4mol/L、0.3 mol/L、0mol/L,若该反应从逆反应方向开始,SO2、O2、SO3的浓度分别为0mol/L、0.1mol/L、0.4mol/L,由于反应为可逆反应,则各物质的浓度一定小于最大浓度,以此来解答。
A项、由于反应为可逆反应,SO2的浓度一定小于0.4mol/L,故A错误;
B项、由于反应为可逆反应,SO2的浓度一定小于0.4mol/L,大于0,则可能为0.25mol/L,故B正确;
C项、SO3、SO2浓度均为0.2mol/L,无论从正反应开始,还是从逆反应开始,只能是一种物质的浓度增大,另一种物质的浓度减小,SO3、SO2浓度不会均为0.15mol/L,故C错误;
D项、由于反应为可逆反应,SO3的浓度一定小于0.4mol/L,故D错误。
故选B。


科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.11 g硫化钾和过氧化钾的混合物,含有的离子数目为0.4NA
B.28 g聚乙烯(![]() )含有的质子数目为16NA
)含有的质子数目为16NA
C.将标准状况下224 mL SO2溶于水制成100 mL溶液,H2SO3、![]() 、
、![]() 三者数目之和为0.01NA
三者数目之和为0.01NA
D.含63 g HNO3的浓硝酸与足量铜完全反应,转移电子数目为0.50NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为光电催化能源化利用CO2制备太阳能燃料的示意图。下列说法不正确的是______
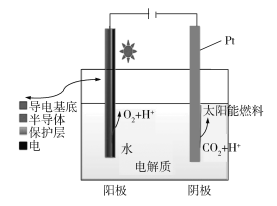
A.阳极反应式为2H2O4e![]() 4H++O2↑
4H++O2↑
B.CO2还原产物可能为CO、HCHO、CH3OH、CH4等
C.阳极、阴极材料互换对制备太阳能燃料影响不大
D.若太阳能燃料为甲醇,则阴极电极反应式为:CO2+6H++6e![]() CH3OH+H2O
CH3OH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是卤代烃的代表,通过对溴乙烷的探究来掌握卤代烃的性质,可以达到举一反三、触类旁通的效果。
I.已知:NaBr+H2SO4(浓) ![]() NaHSO4+ HBr
NaHSO4+ HBr
CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
溴乙烷的沸点38.4℃,实验室制备溴乙烷(CH3CH2Br)的装置和步骤如下:
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL78%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
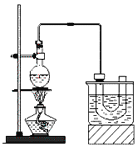
回答下列问题:
(1)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是_______________。
(2)浓硫酸具有强氧化性,能氧化还原性气体HBr为Br2,导致U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质Br2,可选择下列试剂中的:______(填序号)
A.NaOH溶液 B.H2O
C.Na2SO3溶液 D.CCl4
分离时所需的主要玻璃仪器是______________(填仪器名称)。要进一步制得纯净的溴乙烷,可用水洗,然后加入无水CaCl2,再进行_________(填操作名称)。
II.溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
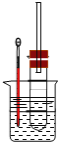
(1)在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL 溴乙烷,将试管如图固定后,加热。试管口安装一长导管的作用是_________。
(2)在试管中加入5 mL NaOH乙醇溶液和5 mL 溴乙烷,将试管如图固定后,加热。
①请写出该反应的化学方程式_____________________________________________。
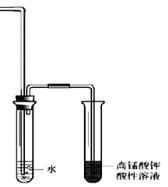
②为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在设计的实验方案中,需要检验的是___________,检验的装置如图所示,在气体通入酸性高锰酸钾溶液前加一个盛水的试管,其作用是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:l的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入![]() 和
和![]() ,一定条件下使反应
,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如图所示
达到平衡,正反应速率随时间变化的示意图如图所示![]() 由图得出的结论不正确的是
由图得出的结论不正确的是
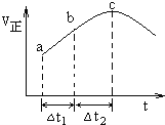
A. 反应过程中压强始终不变
B. 反应物浓度:a点大于b点
C. 反应物的总能量高于生成物的总能量
D. ![]() 时,
时,![]() 的转化率:
的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中对应关系正确的是
A | CH3CH3+Cl2 | 均为取代反应 |
B | 由油脂得到甘油 | 均发生了水解反应 |
C | Cl2+2Br=2Cl+Br2 | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O+4NaOH+O2↑ | 均为水作还原剂的氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯。用如图所示装置探究废旧塑料的再利用。下列叙述不正确的是
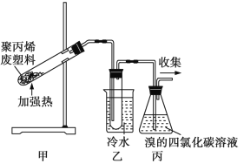
A.装置乙试管中收集到的液体在催化剂存在下可以与Br2发生取代反应
B.装置丙中的试剂吸收反应产生的气体后得到的产物的密度均比水大
C.最后收集的气体可以作为清洁燃料使用
D.甲烷的二氯代物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s内反应的平均反应速率为__;
(2)10s末,生成物D的浓度为__;
(3)若改变下列条件,生成D的速率如何变化(用“增大”“减小”或“不变”填空)。
编号 | 改变的条件 | 生成D的速率 |
① | 降低温度 | ___ |
② | 增大A的浓度 | ___ |
③ | 使用正催化剂 | ___ |
④ | 恒容下充入Ne (不参与体系反应) | ___ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com