
分析 (1)利用三段式法计算平衡浓度,根据平衡常数表达式计算;
(2)根据影响化学平衡的因素进行判断;
(3)原电池负极发生氧化反应,SO2被氧化生成SO42-;
(4)升高温度,加快反应速率到达平均的时间缩短,逆反应速率增大更多,平衡向逆反应方向移动,三氧化硫的含量降低;增大压强,加快反应速率到达平均的时间缩短,正反应速率增大更多,平衡向正反应方向移动,三氧化硫的含量增大,据此结合图象判断;
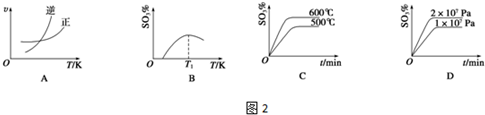
(5)①由A到B状态改变压强,温度不变,而平衡常数只受温度影响;
②在第5分钟末将容器的体积缩小一半后,压强增大平衡正向进行,若在第8分钟末达到新的平衡(此时SO3的浓度约为0.25mol/L),依据三氧化硫浓度变化,和平衡浓度画出变化图象.
解答 解:(1)SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-98kJ•mol-1,在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ,则消耗SO2 2mol,
SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-98kJ•mol-1,
起始 4.0mol 10.0mol 0
转化 2.0mol 1.0mol 2mol
平衡 2.0mol 9.0mol 2mol
则平衡时各组分的浓度为:c(SO2)=0.02mol/L,c(O2)=0.09mol/L,c(SO3)=0.02mol/L,
所以K=$\frac{0.02}{0.02×\sqrt{0.09}}$=$\frac{10}{3}$,
故答案为:$\frac{10}{3}$;
(2)A.保持温度和容器体积不变,充入2mol SO3,平衡向逆反应分析移动,则SO2、O2、SO3气体平衡浓度都比原来增大,故A正确;
B.保持温度和容器体积不变,充入2mol N2,对平衡移动没有影响,各物质的浓度不变,故B错误;
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2,平衡向正反应方向移动,则SO2、O2、SO3气体平衡浓度都比原来增大,故C正确;
D.保持温度和容器内压强不变,充入1mol SO3,处于等效平衡状态,浓度不变,故D错误;
E.升高温度,平衡向逆反应分析移动,SO3的浓度减小,故E错误;
F.移动活塞压缩气体,体积减小,各物质的浓度都增大,故F正确;
故答案为:ACF;
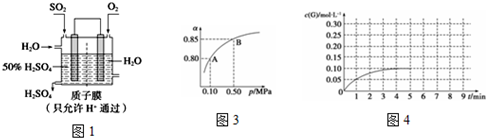
(3)依据图装置分析,二氧化硫失电子发生氧化反应,二氧化硫被氧化为三氧化硫溶于水生成硫酸,电极反应为:SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-═SO42-+4H+;
(4)A.升高温度,逆反应速率增大更多,平衡向逆反应方向移动,图象与实际符合,故A正确;
B.该反应为可逆反应,温度为0时三氧化硫的百分含量不可能为0,图象与实际不相符,故B错误;
C.升高温度,加快反应速率到达平均的时间缩短,逆反应速率增大更多,平衡向逆反应方向移动,三氧化硫的含量降低,图象与实际不符,故C错误;
D.增大压强,加快反应速率到达平均的时间缩短,正反应速率增大更多,平衡向正反应方向移动,三氧化硫的含量增大,图象与实际符合,故D正确;
故答案为:AD;
(5))①平衡常数只受温度影响由A到B状态改变压强,温度不变,则平衡常数不变,即K(A)=K(B),
故答案为:=;
②在第5分钟末将容器的体积缩小一半后,压强增大平衡正向进行,若在第8分钟末达到新的平衡(此时SO3的浓度约为0.25mol/L),依据三氧化硫浓度变化和平衡浓度画出变化图象为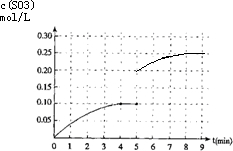 ,
,
故答案为: .
.
点评 本题考查较为综合,涉及化学平衡常数的有关计算、影响化学平衡的因素、平衡图象、电解原理与计算等,题目难度中等,明确化学平衡及其影响为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 干冰气化 | B. | O2转变成O3 | C. | 加热NH4HCO3 | D. | 加热NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
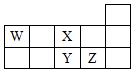
| A. | Z、Y、X的原子半径依次减小,非金属性依次降低 | |
| B. | Z、Y、W的最高价氧化物对应水化物的酸性依次降低 | |
| C. | WH4与Z元素的单质在一定条件下可能发生化学反应 | |
| D. | W的位置是第2周期、第ⅣA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 有白色沉淀生成 | 溶液中不一定含有SO42- |
| B | 向装有Fe(NO3)2溶液试管中加入稀H2SO4 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| C | 向CH3CH2X中加入少量AgNO3溶液,加热 | 有浅黄色沉淀生成 | CH3CH2X中含有Be+ |
| D | 向淀粉溶液中加入稀H2SO4加热几分钟,冷却后再加入新制Cu(OH)2溶液,加热 | 没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -1 528.6kJ•mol-1 | B. | -1 473kJ•mol-1 | ||
| C. | +1 473 kJ•mol-1 | D. | +1 528.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 称量药品时间过长 | |
| C. | 定容时俯视液面 | |
| D. | 洗涤烧杯和玻棒的溶液转入容量瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com