
 已知锌及其化合物的性质与铝及其化合物相似.现向ZnCl2溶液中逐渐滴加NaOH溶液,溶液的pH与某些离子的浓度关系如图(横坐标为溶液的pH,纵坐标为Zn2+或ZnO22-的物质的量浓度;假设Zn2+的浓度为10-5mol/L时,Zn2+已沉淀完全).则下列说法正确的是( )
已知锌及其化合物的性质与铝及其化合物相似.现向ZnCl2溶液中逐渐滴加NaOH溶液,溶液的pH与某些离子的浓度关系如图(横坐标为溶液的pH,纵坐标为Zn2+或ZnO22-的物质的量浓度;假设Zn2+的浓度为10-5mol/L时,Zn2+已沉淀完全).则下列说法正确的是( )| A. | pH≥12时,发生反应的离子方程式为Zn2++4OH-═ZnO22-+2H2O | |
| B. | 若要使ZnCl2溶液中Zn2+沉淀完全,加入的NaOH溶液越多越好 | |
| C. | 向1L0.1mol/LZnCl2溶液中逐渐滴加NaOH溶液至pH=7,需NaOH 0.2mol | |
| D. | 若溶液的温度保持不变,则该温度下Zn(OH)2的溶度积Ksp=10-17 |
分析 A、由图象可知溶液的碱性较强时,锌的存在形式为ZnO22-,结合元素守恒书写方程;
B、加入的NaOH溶液越多越好,沉淀转化为ZnO22-;
C、根据图象知,pH=7时,c(Zn2+)=10-3mol/L,根据反应的锌离子的物质的量计算需要的氢氧化钠的物质的量;
D、Ksp=c(Zn2+).c2(OH-).
解答 解:A、由图象可知溶液的碱性较强时,锌的存在形式为[Zn(OH)4]2-,所以其反应的离子方程式为:Zn2++4OH-═ZnO22-+2H2O,故A正确;
B、加入的NaOH溶液越多越好,沉淀转化为ZnO22-,所以沉淀又溶解,故B错误;
C、根据图象知,pH=7时,C(Zn2+)=10-3mol/L,即只有部分锌离子生成氢氧化锌沉淀,则加入的n(NaOH)<2n(ZnCl2),故C错误;
D、Zn2+离子浓度为10-5mol•L-1时,Zn2+离子已沉淀完全,当溶液的pH=8.0时,c(Zn2+)=10-5 mol•L-1,c(OH-)=10-6 mol•L-1,Ksp=c(Zn2+).c2(OH-)=10-5•(10-6)2=10-17,故D正确;
故选AD.
点评 本题考查了难溶电解质的溶解平衡,难度不大,要注意:计算氢氧化锌的溶度积时,往往容易直接把溶液的pH当作氢氧根离子浓度来计算,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | 军舰船底镶嵌锌块,锌作正极,以防船体被腐蚀 | |
| D. | 硝化甘油是由甘油(丙三醇)硝化制得,它属于酯类 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子晶体中的每个分子内一定含有共价键 | |
| B. | 原子晶体中的相邻原子间可能存在极性共价键 | |
| C. | 离子晶体中可能含有共价键 | |
| D. | 金属晶体的熔点和沸点都很高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 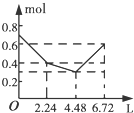 | B. | 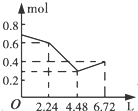 | C. | 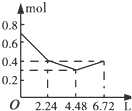 | D. | 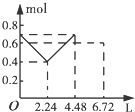 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
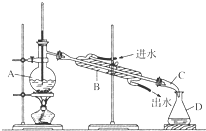 某同学设计了如图所示装置进行石油蒸馏的实验,请回答下列有关问题:
某同学设计了如图所示装置进行石油蒸馏的实验,请回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均存在电离平衡和水解平衡 | |
| B. | 分别加入NaOH固体,恢复至原温,c(CO32-)均增大 | |
| C. | c(OH-)前者大于后者 | |
| D. | 存在的粒子种类相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 4.5 | C. | 5.5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44gCO2 的体积为22.4L | |
| B. | 标准状况下,22.4L水中含有NA个水分子 | |
| C. | 常温常压下,28gN2中所含的原子数目为2NA | |
| D. | 如果11.2LN2中含有n个氮气分子,则阿佛加德罗常数一定为2n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com