
【题目】离子RO4n-中共有x个核外电子,R原子的质量数为A,则R原子核内含中子的数目
A.A+n+32-xB.A+n-24-xC.A-n+24-xD.A+n+24-x
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为短周期元素,原子序数依次递增.A元素原子核内无中子.B元素原子核最外层电子数是次外层电子数的2倍.C元素是地壳中含量最多的元素.D是短周期元素中金属性最强的元素.E与F的位置相邻,F的最高价氧化物的水化物为最强酸.
(1)推断B在元素周期表中的位置:第周期,第族.
(2)写出F的电子排布式: .
(3)C、D可形成淡黄色的粉末,其电子式为 .
(4)写出A与C形成的10电子微粒的化学式:、、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在托盘天平的两盘,放上质量相等的A、B两烧杯,调至平衡,然后分别倒入质量相等的足量盐酸,继而在AB两烧杯中放入下述各组物质,结果天平仍保持平衡的是()
A. 0.8molNa和0.5molMg B. 0.1molZn和0.1molAl
C. 8.4gMgCO3和8.4gNaHCO3 D. 10gCaCO3和10gMgCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
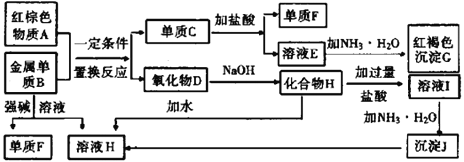
(1)如果把红棕色物质A换成黑色磁性晶体,推测出来的物质是完全一致的,请写出黑色磁性晶体与过量盐酸反应的化学方程式_______________________________。
(2)写出单质B与强碱溶液反应的离子方程式:_______________________________。把溶液Ⅰ中的阳离子完全转化为沉淀J为什么加氨水而不加氢氧化钠_______________。
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式:_________________________。白色沉淀L最终变为红褐色沉淀G,写出L变为G的化学反应方程式_________________________。
(4)保存E溶液时候为什么要加入单质C,用离子方程式解释_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题
(1)KAl(SO4)2的电离方程式_______________________。
(2)向石蕊试液中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是______________、_________________ (填微粒符号)。
(3)实验室用质量分数为36.5%,密度为1.19g·cm-3的浓盐酸来配制100ml,2mol/L的稀盐酸,需要用量筒量取_______________ml该浓盐酸。
(4)化学方程式H2S+H2SO4(浓)=SO2↑+S↓+2H2O,当生成4.48L(标况) SO2时,转移的电子是__________mol。
(5)下列四个图像中,横坐标表示加入物质的物质的量,纵坐标表示生成沉淀的量或产生气体的量,从A~D中选择符合各题要求的序号填人表中。
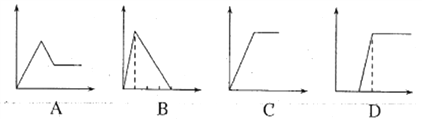
溶液 | 加入的物质 | 序号 |
①AlCl3溶液 | 通入过量的NH3 | ___ |
②Na2CO3和NaOH的溶液 | 滴入过量的盐酸 | ___ |
③NaAlO2溶液 | 滴加稀硫酸至过量 | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备碱式碳酸铜的流程如下:
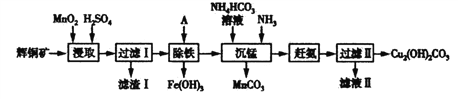
(1)辉铜矿中铜元素的价态为_________________。
(2)滤渣Ⅰ的成分除了不溶性矿渣外,还有S、__________、______________,写出“浸取”过程中生成S 的离子方程式_______________________。
(3)也可用FeCl3代替MnO2作浸取剂。若向FeCl3浸取液中加入CuCl2 ,能加快铜元素的浸取速率,该过程的反应原理可用化学方程式表示为:①Cu2S+2CuCl2=4CuCl+S;②____________。
(4)“沉锰”时发生的反应的离子方程式为____________________。
(5)滤液Ⅱ经结晶得到的盐主要是____________(填化学式,下同),流程中可循环的物质是_________________。
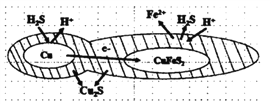
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见下图,转化时负极的电极 反应式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(1)该硫酸的物质的量浓度为________________;
(2)实验室用该硫酸配制240mL0.46 mol·L-1的稀硫酸,则
① 需要该硫酸的体积为________mL;
② 有以下仪器: A 烧杯 B 100mL量筒 C 250mL容量瓶
D 500mL容量瓶 E 玻璃棒 F 托盘天平(带砝码)
G 10mL量筒 H 胶头滴管。配制时,必须使用的仪器有______________(填代号);
![]() ③ 配制过程中有几个关键的步骤和操作如下图所示:将上述实验步骤A—F按实验过程先后次序排列。
③ 配制过程中有几个关键的步骤和操作如下图所示:将上述实验步骤A—F按实验过程先后次序排列。
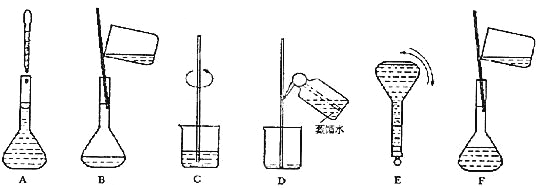
④ 该同学实际配制得到的浓度为0.45 mol·L-1,可能的原因是_________
A.量取浓H2SO4时仰视刻度 | B.容量瓶洗净后未经干燥处理 |
C.没有将洗涤液转入容量瓶 | D.定容时仰视刻度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com