
 ��
�� ��
�� ��
�� ���� ��1�� �к���8��C��8��H��1mol���ĺ���������CxHy������ȡ���ڣ�x+$\frac{y}{4}$����
�к���8��C��8��H��1mol���ĺ���������CxHy������ȡ���ڣ�x+$\frac{y}{4}$����
��2������ϩ�д���̼̼˫����
��3������ϩ����̼̼˫�����ܹ����巢���ӳɷ�Ӧ��
��4������ϩ����̼̼˫����ͨ���ӳɾۺ����ɾ۱���ϩ��
��5������ϩ��������һ���Գ��ᣬ��������5����ԭ�ӿ��Ա�ȡ��������������ϩ��̼ԭ�����ڵ�̼������̼���ڶԳ�λ�ã����Թ������֣�
��� �⣺��1�� �к���8��C��8��H�����������ʽΪ��C8H8��1mol����ϩ��ȫȼ���������������ʵ���Ϊ1mol����8+$\frac{8}{4}$��=10mol��
�к���8��C��8��H�����������ʽΪ��C8H8��1mol����ϩ��ȫȼ���������������ʵ���Ϊ1mol����8+$\frac{8}{4}$��=10mol��
�ʴ�Ϊ��C8H8��10��
��2��̼̼˫��Ϊ����ϩ�Ĺ����ţ��ʴ�Ϊ��̼̼˫����
��3������ϩ���巢���ӳɷ�Ӧ������ʽΪ��C6H5-CH=CH2+Br2��C6H5-CHBr-CH2Br���ʴ�Ϊ��C6H5-CH=CH2+Br2��C6H5-CHBr-CH2Br��
��4������ϩ�����ӳɾۺϷ�Ӧ�Ļ�ѧ����ʽΪ�� ��
��
�ʴ�Ϊ�� ��
��
��5������ϩ���������������ϵ�һ��ȡ�����ﹲ�����֣���������ϩ��̼ԭ�����ڵ�̼ԭ���ϣ�����̼ԭ���ϣ���Ե�̼ԭ���ϣ��ֱ�ȡ�����ṹ��ʽΪ�� ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼�����л�������ṹ����ѧ����ʽ��д����ȷ�л����й������ǽ���ؼ���ע���õ�Ч��ԭ�ӷ���һ�ȴ���Ľṹ����Ŀ�Ѷ��еȣ�


 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д� �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д� ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Al��Cu��ϡH2SO4���ԭ��أ��ŵ�ʱSO42-��Al�缫�ƶ� | |
| B�� | ��Mg��Al��NaOH��Һ���ԭ��أ��为����ӦʽΪ��Al-3e-+4OH-=AlO2-+2H2O | |
| C�� | ��Al��Cu��Ũ�������ԭ�������Դ����ʯī�缫�������������Һ��������1 mol Agʱ������ͭ�缫32 g | |
| D�� | ��Fe��Cu��FeCl3��Һ���ԭ��أ��为����ӦʽΪ��Cu-2e-=Cu2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��п����ϡ���ᷴӦ�Ʊ�H2 | B�� | ��NH4NO3������ȡNH3 | ||
| C�� | ����ʯ��ϡ���ᷴӦ�Ʊ�CO2 | D�� | ����ɫ��Ӧ�������NaCl�� KCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
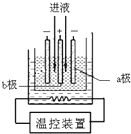 �����̿�MnO2����������FeS2��������������̣�MnSO4��������һ����ȡ ���������̣�EMD���Ĺ����������£�
�����̿�MnO2����������FeS2��������������̣�MnSO4��������һ����ȡ ���������̣�EMD���Ĺ����������£� Fe��OH��3+3H+������CaCO3������CaCO3��s��
Fe��OH��3+3H+������CaCO3������CaCO3��s�� Ca2+��aq��+CO32-��aq����CO32-+2H+�TCO2��+H2O��ʹ��Fe3+��ˮ��ƽ��������Ӧ�����ƶ���Fe3+ת��ΪFe��OH��3����������ȥ��
Ca2+��aq��+CO32-��aq����CO32-+2H+�TCO2��+H2O��ʹ��Fe3+��ˮ��ƽ��������Ӧ�����ƶ���Fe3+ת��ΪFe��OH��3����������ȥ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
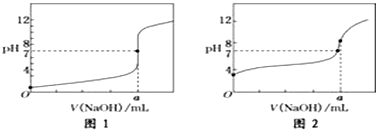
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | �Ե��������嵥��ֻ�ܷ���ȡ����Ӧ | |
| B�� | 1 mol�Ե���������ܺ�8mol���������ӳɷ�Ӧ | |
| C�� | �Ե�����ܷ���ȡ����Ӧ����ȥ��Ӧ | |
| D�� | 1 mol�Ե������������6 mol NaOH������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����ȷ����Ϊ��������
����ȷ����Ϊ��������| A�� | 3��3��4-�������� | B�� | 3��3-����-4-�һ����� | ||
| C�� | 2-�һ�-3��3-����-4-�һ����� | D�� | 2��3��3-�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
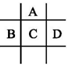
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com