
【题目】利用下图所示装置可以模拟铁的电化学腐蚀。下列说法中,正确的是

A. 若X为碳棒,开关K置于M处可以减缓铁的腐蚀
B. 若X为铜棒,开关K置于N处可以加快铁的腐蚀
C. 若X为碳棒,开关K置于M处,则为牺牲阳极的阴极保护法
D. 若X为碳棒,开关K置于N处,则为外加电流的阴极保护法
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乙烯的结构简式可以表示为CH2CH2
B.苯、乙醇和乙酸都能发生取代反应
C.乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
D.液化石油气和天然气的主要成分都是甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
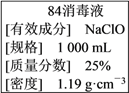
(1)消毒液”的物质的量浓度约为______ mol·L-1。
(2)某同学取100 mL 该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
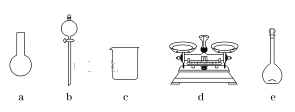
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1。
②需用浓硫酸的体积为________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO 4)是一种新型、高效、多功能水处理剂,下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6□+8H2O。下列说法不正确的是
A. 每转移1mole-,可以得到33g K2FeO4
B. □处的物质应为KCl
C. 该反应中铁元素的化合价升高
D. 氧化性:Cl2>K2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
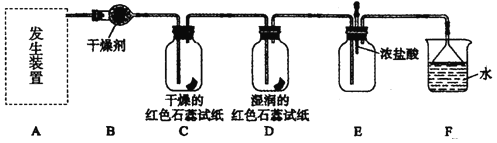
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分挟持装置已略去)进行实验:
(1)写出实验室用固体制取氨气的化学方程式___________________________。
(2)利用上述原理,实验室制取氨气应选用下图中________发生装置进行实验。
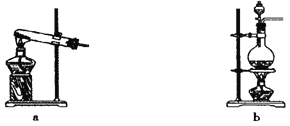
(3)B装置中的干燥剂可选用________(填“碱石灰”或“浓硫酸”)。
(4)气体通过C、D装置时,试纸颜色会发生变化的是________(填“C”或“D”),试纸颜色变为___________。
(5)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,发生的化学反应是____________可观察到的现象是____________。
(6)F装置的作用是____________,装置中倒扣的漏斗是为了_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应均可获取CO。下列有关说法正确的是
①木炭不完全燃烧制CO:2C(s)+O2(g)=2CO(g) ΔH1=-221kJ·mol-1
②木炭还原CO2制CO:C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
③焦炭还原Fe2O3制CO:Fe2O3(s) + 3C(s) ![]() 2Fe(s) + 3CO(g) ΔH 3=+489.0kJ·mol-1
2Fe(s) + 3CO(g) ΔH 3=+489.0kJ·mol-1
A. 反应①中化学能全部转化为热能
B. 反应②为吸热反应,在任何情况下都不能自发进行
C. 反应③中使用催化剂或移走部分CO,均可提高Fe2O3的转化率
D. 反应Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) ΔH =-28.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能。“金属(M)空气电池”(如下图)具有原料易得、能量密度高等优点。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。下列说法不正确的是
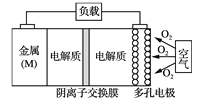
A. “金属(M)空气电池”放电过程的正极反应式: O2+2H2O+4e-=4OH-
B. 比较Mg、Al、Zn三种“金属—空气电池”,“Al—空气电池”的理论比能量最高
C. 电解质溶液中的阴离子从负极区移向正极区
D. 在“M—空气电池”中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)我国首创以铝_空气_海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是________,负极反应为_____________;正极材料是__________,正极反应为_______________。
(2)熔盐电池具有高的发电效率,因而受到重视, 可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。阳极反应式:2CO+2CO![]() -4e-===4CO2,阴极反应式:____________,电池总反应式:____________ 。
-4e-===4CO2,阴极反应式:____________,电池总反应式:____________ 。
(3)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为_______________。若改用AlCl3水溶液作电解液,则阴极产物为_________。
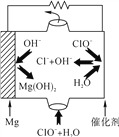
(4) “镁-次氯酸盐”燃料电池的装置如图所示,该电池的正极反应式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中符合下列图像的是( )

A. N2(g)+3H2(g)![]() 2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com