


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、发生装置与用KClO3制取O2的装置相同 |
| B、可用排饱和氯化铵溶液的方法收集氨气 |
| C、氨气的验满可以用湿润的红色石蕊试纸或沾有浓盐酸的玻璃棒放于试管口附近 |
| D、所用的铵盐不是NH4NO3,是因为NH4NO3受热易爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
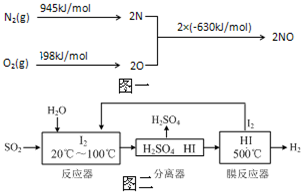 中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
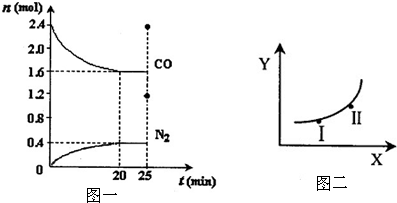
| 条件X | 变量Y | |
| a | 压强 | 反应的平衡常数 |
| b | 温度 | CO的平衡浓度 |
| c | 温度 | N2的体积分数 |
| d | 催化剂 | NO的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com