
【题目】C1化学是目前研究的热点问题。
(1)己知:2C(s)+O2(g)=2CO(g) △H =a kJ·mol-1 C(s)+H2O(g)=CO(g)+H2(g) △H =+130kJ·mol-1 H-H、O=O、H-O键的键能分别为436kJ/mol、496kJ/mol、462kJ/mol。则a=_______。
(2)以甲醇为原料制备H2的一种原理如下:
I.CH3OH(g) ![]() CO(g)+2H2(g) △H =+90kJ·mol-1
CO(g)+2H2(g) △H =+90kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H =-41kJ·mol-1
CO2(g)+H2(g) △H =-41kJ·mol-1
①在绝热恒容密闭容器中,加入一定量的CH3OH(g)在一定条件下发生反应I,下列情况能说明该反应达到平衡状态的是____________(填代号)
A.容器内温度不变
B.容器内气体总质量不再变化
C.CH3OH(g)和CO(g)的浓度之比不再变化
D.混合气体的密度不再变化
②温度为T℃时,向10L恒容密闭容器中充入1molCH3OH(g)和lmolH2O(g),发生反应I和反应II,达到平衡时测得CO的物质的量为0.4mol,CO2的物质的量为0.2mol。则反应II的平衡常数K=_____。该温度下,在某时刻平衡体系中c(CO2)=2mol/L、c(H2)=2mol/L、c(CO)=4mol/L、c(H2O)=4mol/L,则该时刻上述反应II的平衡移动方向为__________(填“正反应方向”、“逆反应方向”或“不移动”)。
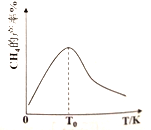
(3)H2和CO在一定条件(温度、压强和催化剂)下合成CH4,发生反应:CO(g)+3H2(g)![]() H4(g)+H2O(g)△H<0。如下图,温度低于T0时,随着温度升高,CH4的产率增大,其原因是_______________________________________________________________。
H4(g)+H2O(g)△H<0。如下图,温度低于T0时,随着温度升高,CH4的产率增大,其原因是_______________________________________________________________。
(4)合成气(H2、CO)不仅是化工原料,也是清洁能源。如果H2和CO以体积比1:1组成混合气体与空气构成碱性燃料电池(KOH溶液为电解质溶液且足量),假设CO和H2同时按比例发生反应,则燃料电池负极的电极反应式为____________________________________________。
【答案】 一220 AC 0.875或7/8 正反应方向 T0之前反应未达到平衡,升高温度,反应速率加快,CH4的产率增大 CO+H2+6OH--4e-=CO32-+4H2O
【解析】(1)①C(s)+H2O(g)=CO(g)+H2(g) △H =+130kJ·mol-1 ,②2C(s)+O2(g)=2CO(g) △H =a kJ·mol-1,根据盖斯定律得①×2-②得:2H2O(g)═O2(g)+2H2(g)△H=(+130kJ·mol-1)×2-(akJ·mol-1),△H=反应物总键能-生成物总键能,则4×462kJ·mol-1-496 kJ·mol-1-462kJ·mol-1=480kJ·mol-1=(+130kJ·mol-1)×2-(akJ·mol-1),解得:a=-220 kJ·mol-1;(2)①A、绝热恒容密闭容器中,容器内温度不变,说明已达到平衡,故A正确;B、反应物和生成物全是气体,容器内气体总质量始终不变化,故B错误;C、CH3OH(g)和CO(g)的浓度之比不再变化,说明已达到平衡,故C正确;D、混合气体的总质量不变,容器的容积不变,混合气体的密度始终不变,故混合气体的密度不再改变,不能说明到达平衡,故D错误;故选AC。
② I. CH3OH(g) ![]() CO(g)+2H2(g)
CO(g)+2H2(g)
n始/mol 1
n变/mol 0.6 0.6 1.2
n平/mol 0.4 0.6 1.2
II. CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
n始/mol 0.6 1 0 1.2
n变/mol 0.2 0.2 0.2 0.2
n平/mol 0.4 0.8 0.2 1.4
温度为T℃时,向10L恒容密闭容器,将平衡时各物质的量,换成浓度,代入平衡常数计算式,反应II的平衡常数K=![]() 。该温度下,在某时刻平衡体系中c(CO2)=2mol/L、c(H2)=2mol/L、c(CO)=4mol/L、c(H2O)=4mol/L,Qc=
。该温度下,在某时刻平衡体系中c(CO2)=2mol/L、c(H2)=2mol/L、c(CO)=4mol/L、c(H2O)=4mol/L,Qc=![]() <K,则该时刻上述反应II的平衡移动方向为正反应方向。(3)CO(g)+3H2(g)
<K,则该时刻上述反应II的平衡移动方向为正反应方向。(3)CO(g)+3H2(g)![]() H4(g)+H2O(g)△H<0。温度低于T0时,随着温度升高,CH4的产率增大,其原因是:T0之前反应未达到平衡,升高温度,反应速率加快,CH4的产率增大;(4)在碱性条件下,CO和H2失电子,被氧化,则燃料电池负极的电极反应式为:CO+H2+6OH--4e-=CO32-+4H2O。
H4(g)+H2O(g)△H<0。温度低于T0时,随着温度升高,CH4的产率增大,其原因是:T0之前反应未达到平衡,升高温度,反应速率加快,CH4的产率增大;(4)在碱性条件下,CO和H2失电子,被氧化,则燃料电池负极的电极反应式为:CO+H2+6OH--4e-=CO32-+4H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氯气是非常重要的化工产品,我国年产量在![]() t左右。氯气的实验室制备有多种不同方法。完成下列填空:
t左右。氯气的实验室制备有多种不同方法。完成下列填空:
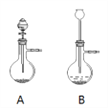
(1)漂粉精固体和盐酸混合即可反应产生氯气,相关的化学反应方程式为:_____________________________________________________。发生装置选择下图中A而不是B的理由是:______________________________
(2)实验室用此法制取纯净的氯气,可将混合气体通过盛有饱和食盐水的装置,目的是___________;为了将氯气干燥,可选用的干燥剂是___________。实验室用向上排空气法收集了一试管氯气,设计一个简单实验,验证所收集的氯气中是否收集满_________________________________________________。
(3)实验室用2.00mol/L盐酸和足量的漂粉精,若产生2.24L(标准状况)氯气,反应转移电子的物质的量是____________________,发生反应的盐酸________mL。
(4)为了比较氯、溴、碘单质的氧化性,将一定量氯气缓缓通入溴化钠溶液中时,可以看到无色溶液逐渐变为__________色;通入碘化钾溶液并加入少量苯振荡并静置后,可发现的现象______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香族化合物与苯酚无论以何种比例混合,只要总物质的量一定,完全燃烧时所消耗的氧气和生成水的质量始终一定.试回答: 
(1)这类物质的相对分子质量与苯酚的相对分子质量之差为的倍数(填数字).
(2)这类物质中相对分子质量最小的物质A的分子式为C7H6O3 . 已知A溶液能与NaHCO3反应放出气体,且能与溴水反应.
①A可能的结构有种.
②现取2.32g苯酚与A的混合物与50.0mL 1.000mol/L的NaOH溶液充分反应后,加水至100mL.取出其中的10.0mL用0.100mol/L的HCl溶液滴定过量的NaOH,消耗20.0mL时至滴定终点.求该混合物中苯酚的质量分数(结果保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是

A. 该制氢工艺中光能最终转化为化学能
B. 该装置工作时,H+由b极区流向a极区
C. a极上发生的电极反应为Fe3++e-=Fe2+
D. a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】c(OH﹣)相同的氢氧化钠溶液和氨水,分别用蒸馏水稀释至原体积的m倍和n倍,若稀释后两溶液的c(OH﹣)仍相同,则m和n的关系是( )
A.m>n
B.m=n
C.m<n
D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沐舒坦在临床上广泛使用,合成路线如下(反应试剂和反应条件均末标出)

已知: 
完成下列填空:
(1)写出反应①所用试剂和反应条件_____________
(2)写出反应类型: 反应③____________反应,⑤__________
(3)写出结构简式A________ B__________
(4)反应⑥中除加入反应试剂C外,还需要加入K2CO3,其目的是为了_________;
(5)写出两种C的能发生水解反应,且只含3种不同化学环境氢原子的同分异构体的结构简式_______、__________。
(6)反应②,反应③的顺序不能颠倒,其原因是________________________。
(7)写出反应⑥的化学反应方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质,但类比是相对的,不能违背客观实际。下列说法中,不正确的是
A. CO2通入水中生成H2CO3,SO2通入水中生成H2SO3
B. CO2通入CaCl2溶液中无明显现象,SO2通入CaCl2溶液中也无明显现象
C. 足量的CO2通入到澄清石灰水中,先生成沉淀后溶解,足量的SO2通入到澄清石灰水中现象相同
D. CO2通入![]() 溶液中生成
溶液中生成![]() 和
和![]() ,SO2通入
,SO2通入![]() 溶液中生成
溶液中生成![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:![]()
![]() 。将一定量的
。将一定量的![]() 充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
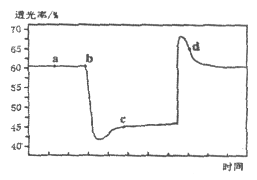
A. b点的操作是压缩注射器
B. c点与a点相比, ![]() 增大,
增大, ![]() 减小
减小
C. 平均摩尔质量: ![]()
D. d点: ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com