
 如图所示,是在其他条件一定时,反应2A+B?2C△H<0,A的最大转化率与温度关系曲线,下列叙述正确的是( )
如图所示,是在其他条件一定时,反应2A+B?2C△H<0,A的最大转化率与温度关系曲线,下列叙述正确的是( )| A、X或Y两点相应,V(正)>V(逆) |
| B、Z、N两点表示未达平衡状态,且都是V(正)>V(逆) |
| C、W点表示非平衡状态,V(正)>V(逆) |
| D、相应反应速率大小的点:W>Y>N |


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
| A、25℃时,0.1 mol/L HF溶液pH=1 |
| B、Ksp(CaF2)随温度和浓度的变化而变化 |
| C、向反应后的溶液中继续加入100m L 0.1 mol/L Na2CO3有CaCO3沉淀产生 |
| D、该体系中有CaF2沉淀产生,且反应后溶液中的F-浓度为1×10-4.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
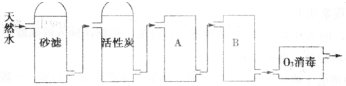
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 加热、加压 |
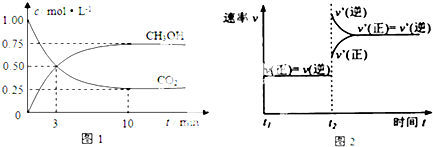
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.01 mol/(L?s) |
| B、v(B)=0.04 mol/(L?s) |
| C、v(B)=0.60mol/(L?min) |
| D、v(C)=1.0mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
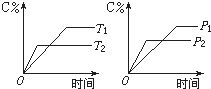 可逆反应mA(s)+nB(g)?pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是( )
可逆反应mA(s)+nB(g)?pC(g)+qD(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,判断下列叙述中正确的是( )| A、到达平衡后,若使用催化剂,C的质量分数增大 |
| B、平衡后,若升高温度,平衡则向逆反应方向移动 |
| C、平衡后,增大A的量,有利于平衡向正反应方向移动 |
| D、化学方程式中一定n>p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:
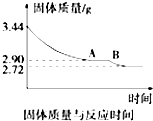 煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能源,也是生产化工产品的重要原料.试用所学知识,解答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ/mol |
| B、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ/mol |
| C、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ/mol |
| D、2CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过滤 | B、加热 | C、蒸馏 | D、溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com