
| A. | Cu2+ Fe2+ NO3- Cl- | B. | K+ Mg2+HCO3-SO42- | ||
| C. | S2- Na+ K+、Cl- | D. | Ba2+Na+ I- NO3- |
分析 碱性条件下,离子之间不能结合生成沉淀、气体、水、弱电解质等可以大量共存;强酸性条件下具有氧化性与具有还原性的离子能发生氧化还原反应,以此来解答.
解答 解:A.OH-与Cu2+、Fe2+能结合生成沉淀,则不能共存,故A不选;
B.OH-与HCO3-结合生成水和碳酸根离子,则不能共存,故B不选;
C.碱溶液中该组离子不反应,则能共存,但在酸性条件下H+、S2- 发生反应生成气体,故C不选;
D.碱溶液中该组离子不反应,则能共存,且在酸性条件下I-、NO3-能发生氧化还原反应,符合题意,故D选.
故选D.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢盐 | B. | 电解质 | C. | 钠盐 | D. | 碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去食盐水中的少量泥沙:过滤,长颈漏斗 | |
| B. | 将水和汽油分离:分液,普通漏斗 | |
| C. | 将碘水中的碘和水分离:萃取,分液漏斗 | |
| D. | 除去自来水中含有的少量Na+和Cl-:蒸发结晶,蒸馏烧瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molO2 和1molN2 所占的体积都约为22.4L | |
| B. | H2 的气体摩尔体积是22.4L | |
| C. | 标况下1molH2 和1molH2O 所占的体积都约为22.4L | |
| D. | 标况下,22.4LN2 和N2O 组成的混合气体中,所含N原子的物质的量约为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,3.36 L煤油含有9.03×1022个煤油分子 | |
| B. | 常温常压下,2 g氢气含有的原子数为1.204×1024个 | |
| C. | 同温同压下,相同体积的任何气体所含的原子数相等 | |
| D. | 22.4 L气体所含分子数一定大于11.2 L气体所含分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L O2中一定含有6.02×1023个氧分子 | |
| B. | 将80 g NaOH 溶于1L 水中,所得溶液中NaOH 的物质的量浓度为2mol/L | |
| C. | 18 g 水在标准状况下的体积为22.4 L | |
| D. | 在标准状况下,20 ml NH3与60 ml O2所含的分子数之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加HCl的浓度 | B. | 加水 | ||
| C. | 增加同浓度盐酸的体积 | D. | 增加压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

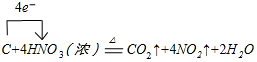 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com