
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,是具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl。
实验1:制备NaClO溶液。(已知:3NaClO![]() 2NaCl+NaClO3)
2NaCl+NaClO3)
(1)如图一装置A中___(仪器名称)内发生反应的化学方程式为___。
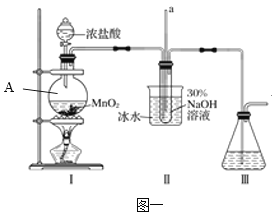
(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,所需玻璃仪器除量筒外还有____(填字母)。
a.烧杯 b.容量瓶 c.玻璃棒 d.烧瓶
(3)图中装置Ⅱ中用冰水浴控制温度的目的是____。
实验2:制取水合肼。
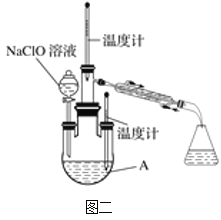
(4)图二中充分反应后,___(填操作名称)A中溶液即可得到水合肼的粗产品。若分液漏斗滴液速度过快,部分N2H4·H2O会参与A中反应并产生大量氮气,降低产品产率。写出该过程反应生成氮气的化学方程式___。
实验3:测定馏分中水合肼的含量。
(5)称取馏分3.0g,加入适量NaHCO3固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.15mol·L-1的碘的标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定时,碘的标准溶液盛放在___(填“酸式”或“碱式”)滴定管中。
②下列能导致馏分中水合肼的含量测定结果偏高的是___(填字母)。
a.锥形瓶清洗干净后未干燥
b.滴定前,滴定管内无气泡,滴定后有气泡
c.读数时,滴定前平视,滴定后俯视
d.盛标准液的滴定管水洗后,直接装标准液
③实验测得消耗I2溶液的平均值为20.00mL,馏分中水合肼(N2H4·H2O)的质量分数___。
【答案】圆底烧瓶 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O ac 防止NaClO受热分解,影响水合肼的产率 蒸馏 N2H4·H2O+2NaClO=N2↑+3H2O+2NaCl 酸式 d 25%
MnCl2+Cl2↑+2H2O ac 防止NaClO受热分解,影响水合肼的产率 蒸馏 N2H4·H2O+2NaClO=N2↑+3H2O+2NaCl 酸式 d 25%
【解析】
(1)如图一装置A中圆底烧瓶内发生反应,浓盐酸与二氧化锰共热反应生成氯化锰、氯气和水,化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。故答案为:圆底烧瓶;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O。故答案为:圆底烧瓶;MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)用NaOH固体配制溶质质量分数为30%的NaOH溶液时,用天平称量一定质量的氢氧化钠固体,在烧杯中加水溶解,并用玻璃棒搅拌,需要玻璃仪器有烧杯、玻璃棒,故答案为:ac;
(3)由题给信息可知,次氯酸钠受热易分解生成氯化钠和氯酸钠,图中装置Ⅱ中用冰水浴控制温度的目的是防止NaClO受热分解,影响水合肼的产率。
故答案为:防止NaClO受热分解,影响水合肼的产率;
(4)图二中充分反应后,蒸馏A中溶液即可得到水合肼的粗产品。N2H4H2O具有强还原性,若分液漏斗滴液速度过快,部分N2H4·H2O与次氯酸钠反应生成氮气、氯化钠和水,该过程反应生成氮气的化学方程式N2H4·H2O+2NaClO=N2↑+3H2O+2NaCl。
故答案为:蒸馏;N2H4·H2O+2NaClO=N2↑+3H2O+2NaCl;
(5)①滴定时,碘的标准溶液具有氧化性,可以腐蚀橡皮管,碘的标准溶液盛放在酸式滴定管中。故答案为:酸式;
②a.锥形瓶清洗干净后未干燥,不影响水合肼的物质的量,对实验结果无影响,故错误;
b.滴定前,滴定管内无气泡,滴定后有气泡会导致碘的标准溶液体积偏小,所测结果偏小,故错误;
c.读数时,滴定前平视,滴定后俯视会导致碘的标准溶液体积偏小,所测结果偏小,故错误;
d.盛标准液的滴定管水洗后,直接装标准液会稀释碘的标准溶液,导致碘的标准溶液体积偏大,所测结果偏高,故正确;
故答案为:d;
③由方程式N2H4·H2O+2I2=N2↑+4HI+H2O可得如下关系N2H4·H2O~2I2,则3.0g馏分中n(N2H4·H2O)=![]() n(I2)×10=
n(I2)×10=![]() ×0.15 mol·L-1×20×10—3L×10=0.015 mol,则馏分中水合肼(N2H4·H2O)的质量分数为
×0.15 mol·L-1×20×10—3L×10=0.015 mol,则馏分中水合肼(N2H4·H2O)的质量分数为![]() ×100%=25%;故答案为:25%。
×100%=25%;故答案为:25%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】液态化合物AB会发生微弱的自身电离,电离方程式为AB![]() A++B-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是( )
A++B-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述正确的是( )
A.c(A+)随温度升高而降低B.在35 ℃时,c(A+)>c(B-)
C.AB的电离程度(25℃)>(35℃)D.AB的电离是吸热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu及化合物在生产、国防中有重要的应用。
I.纳米级Cu2O既是航母舰艇底部的防腐蚀涂料,也是优良的催化剂。
(1)已知:Cu2O(s)+![]() O2(g)=2CuO(s) ΔH=-196kJ·mol-1
O2(g)=2CuO(s) ΔH=-196kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-220.8kJ·mol-1
则工业上用碳粉与CuO粉末混合在一定条件下反应制取Cu2O(s),同时生成CO气体的热化学方程式为___。
(2)用纳米级Cu2O作催化剂可实现甲醇脱氢制取甲醛:CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示。
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示。
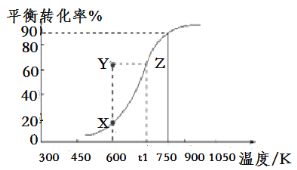
①该反应的ΔH___0(填“>”或“<”);600K时,Y点甲醇的v(正)___v(逆)(填“>”或“<”)。
②在t1K时,向固定体积为1L的密闭容器中充入2molCH3OH(g),温度保持不变,9分钟时达到平衡,则0~9min内用CH3OH(g)表示的反应速率v(CH3OH)___,温度为t1时,该反应的平衡常数K的表达式为___。
II.Cu既是常见的催化剂,又是常见的电极材料。
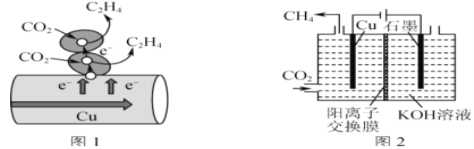
(3)图1表示的是利用CO2的“直接电子传递机理”。在催化剂铜的表面进行转化。当直接传递的电子物质的量为2mol时,则参加反应的CO2的物质的量为___。
(4)图2表示以KOH溶液作电解质溶液进行电解的示意图,CO2在Cu电极上可以转化为CH4,该电极反应的方程式为___。
III.含铜离子的废水会造成污染,通常将其转化为硫化铜沉淀而除去。
(5)已知:Ksp(CuS)=1×10-36,要使铜离子的浓度符合排放标准(不超过6.25×10-6mol/L),溶液中的硫离子的物质的量浓度至少为___mol/L(保留至小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香酯Ⅰ的合成路线如下:
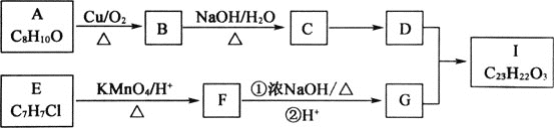
已知以下信息:
①A~I均为芳香族化合物,B能发生银镜反应,D的相对分子质量比C大4,E的核磁共振氢谱有3组峰。
②![]()
![]()
![]()
③2RCH2CHO![]()

请回答下列问题:
⑴A→B的反应类型为________,D所含官能团的名称为________,E的名称为________。
⑵E→F与F→G的顺序能否颠倒________![]() 填“能”或“否”
填“能”或“否”![]() ,理由是________。
,理由是________。
⑶B与银氨溶液反应的化学方程式为________。
⑷Ⅰ的结构简式为________。
⑸符合下列要求的A的同分异构体还有________种。
①与Na反应并产生H2
②芳香族化合物
⑹根据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任选)_______。合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题小组合成了一种复合材料的基体M的结构简式为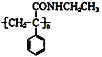 ,合成路线如下
,合成路线如下
![]()
已知:R—CN![]() R—COOH
R—COOH
请回答下列问题:
![]() 有机物C分子结构中含有的官能团有______________。
有机物C分子结构中含有的官能团有______________。
![]() 写出A的结构简式 _________________。
写出A的结构简式 _________________。
![]() 反应①、②的反应类型分别为 _______________、 ________________。
反应①、②的反应类型分别为 _______________、 ________________。
![]() 写出反应③的化学方程式 ________________。
写出反应③的化学方程式 ________________。
![]() 写出符合下列条件:①能使
写出符合下列条件:①能使![]() 溶液显紫色;②只有二个取代基;③与新制的
溶液显紫色;②只有二个取代基;③与新制的![]() 悬浊液混合加热,有砖红色沉淀生成;有机物B的一种同分异构体的结构简式 _____________。
悬浊液混合加热,有砖红色沉淀生成;有机物B的一种同分异构体的结构简式 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是![]()
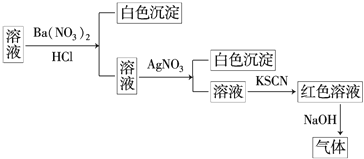
A.原溶液中一定含有![]() B.原溶液中一定含有
B.原溶液中一定含有![]()
C.原溶液中一定含有![]() D.原溶液中一定含有
D.原溶液中一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和 2molB进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是 K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加 B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com