
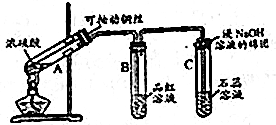
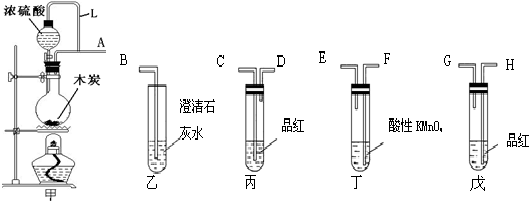
分析 (1)金属铜可以和浓硫酸之间反应生成硫酸铜、水以及二氧化硫;
(2)二氧化硫具有漂白性,能使品红褪色,加热,溶液恢复颜色;
(3)二氧化硫是酸性气体,能使紫色的石蕊试液变为红色;
(4)二氧化硫有毒,是酸性气体,可以和强碱氢氧化钠溶液反应,据此回答.
解答 解:(1)金属铜可以和浓硫酸之间反应生成硫酸铜、水以及二氧化硫,反应为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫具有漂白性,能使品红褪色,所以试管B中的实验现象是品红溶液褪色,对该试管中反应后的溶液加热,溶液恢复颜色,故答案为:品红溶液褪色;溶液恢复颜色;
(3)二氧化硫是酸性气体,能使紫色的石蕊试液变为红色,故答案为:石蕊试液变红;
(4)二氧化硫有毒,是酸性气体,为防止污染可以用强碱氢氧化钠溶液来吸收,发生反应为:SO2+2OH-=SO32-+H2O,故答案为:吸收二氧化硫;SO2+2OH-=SO32-+H2O.
点评 本题考查了浓硫酸性质的分析判断,产物的实验设计和实验验证方法、试剂选择、反应现象的判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯水、盐酸、火碱、硫酸钡 | B. | 水银、硫酸、烧碱、硫酸氢钠 | ||
| C. | 铜、醋酸、石灰石、氯化铜 | D. | 臭氧、硝酸、纯碱、胆矾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  点燃酒精灯 | B. |  称取氯化钠 | C. |  液体加热 | D. |  量取9.5mL的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
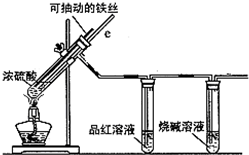 某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验.
某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| NO的物质的量(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com