
【题目】将12.8g铜片加入到100mL一定浓度的硝酸溶液中,铜片完全溶解,产生NO和NO2的混合气体4.48L(标准状况下);若向反应后的溶液中加入400mL 2mol/LNaOH溶液,能使溶液中的Cu2+恰好完全沉淀.下列说法不正确的是![]()
![]()
A.铜片与硝酸反应过程中转移电子0.4mol
B.反应后溶液中剩余![]() 的物质的量为0.4mol
的物质的量为0.4mol
C.混合气体中NO和![]() 的体积之比为1:1
的体积之比为1:1
D.原硝酸溶液的物质的量浓度为10mol/L
【答案】B
【解析】
铜的物质的量n=![]() =0.2mol,反应后铜化合价升高到+2价,可知失去的电子的物质的量为0.4mol,设混合气体中NO为x mol,NO2为 ymol,那么可列出二元一次方程组计算NO和NO2的物质的量,据此进行分析判断。
=0.2mol,反应后铜化合价升高到+2价,可知失去的电子的物质的量为0.4mol,设混合气体中NO为x mol,NO2为 ymol,那么可列出二元一次方程组计算NO和NO2的物质的量,据此进行分析判断。
A.由于12.8g铜的物质的量![]() =0.2mol,而由于铜反应后变为+2价,故0.2mol铜失去的电子的物质的量为0.4mol,即转移的电子为0.4mol,A项正确,不符合题意;
=0.2mol,而由于铜反应后变为+2价,故0.2mol铜失去的电子的物质的量为0.4mol,即转移的电子为0.4mol,A项正确,不符合题意;
B.加入氢氧化钠溶液使铜离子完全沉淀后的溶液中的溶质是NaNO3,所以溶液中反应剩余的n(NO3-)=n(Na+)=cV=2mol/L×0.4L=0.8mol,B项错误,符合题意;
C. 12.8g铜的物质的量![]() =0.2mol,而由于铜反应后变为+2价,故0.2mol铜失去的电子的物质的量为0.4mol,在氧化还原反应中得失电子数相同,设混合气体中NO为xmol,NO2为ymol,则有:
=0.2mol,而由于铜反应后变为+2价,故0.2mol铜失去的电子的物质的量为0.4mol,在氧化还原反应中得失电子数相同,设混合气体中NO为xmol,NO2为ymol,则有:
![]() ,解得
,解得![]() ,因此两气体的物质的量之比为1:1,而体积之比等于物质的量之比,故体积之比也为1:1,C项正确,不符合题意;
,因此两气体的物质的量之比为1:1,而体积之比等于物质的量之比,故体积之比也为1:1,C项正确,不符合题意;
D.原硝酸溶液反应后,一部分氮元素变为NO和NO2以气体的形式从反应容器中逸出,而另一部分氮元素以NO3-的形式存在于溶液中。当加入NaOH溶液使溶液中的Cu2+恰好完全沉淀时,溶液中的溶质为NaNO3,此时溶液中n(NO3-)=n(Na+)=cV=2mol/L×0.4L=0.8mol,即反应后溶液中剩余NO3-的物质的量为0.8mol,而逸出的气体中含有的N原子的物质的量![]() =0.2mol,则可知原硝酸的物质的量n=0.8mol+0.2mol=1mol,则物质的量浓度为c=
=0.2mol,则可知原硝酸的物质的量n=0.8mol+0.2mol=1mol,则物质的量浓度为c=![]() =10mol/L,D项正确,不符合题意。
=10mol/L,D项正确,不符合题意。
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有机物M的相对分子质量不超过150,经测定M具有下列性质:
①能燃烧,燃烧产物只有CO2和H2O
②M与醇或羧酸在浓硫酸存在下均能生成有香味的物质
③在一定条件下,M能发生分子内脱水反应,其生成物与溴水混合,溴水褪色
④0.1molM与足量NaHCO3溶液反应产生4.48L(标准状况下)气体
下列物质与M互为同系物的是( )
A.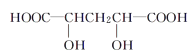 B.
B.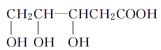
C.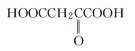 D.
D.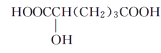
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,下列有关电解质溶液的说法不正确的是( )
A.pH相等的四种溶液:a.CH3COONa b.Na2CO3 c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
B.0.1mol·L-1的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
C.1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液,前者含NH4+ 物质的量多
D.浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列设计的实验方案能达到相应实验目的的是![]()
![]()
选项 | 实验目的 | 实验方案 |
A | 探究化学反应的限度 | 取 |
B | 探究浓度对化学反应速率的影响 | 用两支试管各取 |
C | 证明溴乙烷的消去反应有乙烯生成 | 将NaOH的乙醇溶液加入溴乙烷中加热,将产生的气体直接通入酸性 |
D | 验证醋酸钠溶液中存在水解平衡 | 取 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+ Cl-+3H+。己知该反应的速率随c(H+)的增大而加快。右图为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图。下列说法中不正确的是 ( )

A. 反应开始时速率增大可能是c(H+)所致
B. 纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合
C. 图中阴影部分的面积表示t1~t2时间内ClO3-的物质的量的减少量
D. 后期反应速率下降的主要原因是反应物浓度减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气H2S经资源化利用后可回收能量并得到单.质硫。反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ·mol-1。H2S燃料电池的工作原理如图所示。下列有关说法不正确的是( )

A. 电极a为电池的负极
B. 电极b上的电极反应式为:O2+4H++4e-=2H2O
C. 若有17gH2S参与反应,则会有1molH+经质子膜进入正极区
D. 若电路中通过2mol电子,则电池内部释放632kJ热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】临床证明磷酸氯喹对治疗“新冠肺炎”有良好的疗效。磷酸氯喹的结构如图所示。下列有关磷酸氯喹的说法错误的是( )
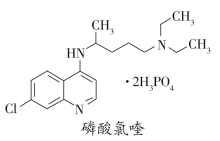
A.分子式是C18H32ClN3O8P2
B.能发生取代、加成和消去反应
C.1mol磷酸氯喹最多能与5molH2发生加成反应
D.分子中的—C1被—OH取代后的产物能与溴水作用生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是![]()
A.在![]()
![]() 溶液中,
溶液中,![]()
B.在![]() 某二元弱酸强碱盐NaHA溶液中,
某二元弱酸强碱盐NaHA溶液中,![]()
C.![]() 和
和![]() 的混合溶液中,若
的混合溶液中,若![]() 大于
大于![]() ,则溶液显酸性
,则溶液显酸性
D.10mL![]() HCl溶液与10mL
HCl溶液与10mL![]()
![]() 溶液充分混合,若混合后溶液的体积为20mL,则溶液的
溶液充分混合,若混合后溶液的体积为20mL,则溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-= AlO2-+H2↑
B.过量铁粉与一定量稀硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.澄清石灰水中加入过量NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com