
�����йػ�ѧ�о�����ȷ˵����
A��ͬʱ�ı������������о���Ӧ���ʵı仯���ܸ���ó��йع���
B������ͬһ����ѧ��Ӧ������������Ӧ�����淴Ӧ���䷴Ӧ���ʱ���ͬ
C������11-17��Ԫ������������Ӧˮ���������Եݱ���ɣ��Ƴ�ͬ����Ԫ�صĽ����ԡ�
�ǽ����Եݱ����
D����HF��HCl��HBr��HI���Ե�������ʵ���Ƴ�F��Cl��Br��I�ķǽ��������Ĺ���
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������������·�Ӧ�Ƶã�
H2SO4��Ũ�� Br2��CCl4��
C4H10O  C4H8
C4H8  C4H8Br2�����������Ľṹ��ʽ��������
C4H8Br2�����������Ľṹ��ʽ��������
A��CH3CH2CHBrCH2Br B��CH3CH(CH2Br)2
C��CH3CHBrCHBrCH3 D��(CH3)2CBrCH2Br
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪������Ԫ�ص����ӣ�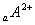 ��
�� ������ͬ�ĵ��Ӳ�ṹ��������������ȷ����
������ͬ�ĵ��Ӳ�ṹ��������������ȷ����
A��ԭ�Ӱ뾶B > A B��ԭ������a > b����
C�����Ӱ뾶B-> A2+ ��D��a=b-3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й��ڻ�ѧ��Ӧ�ȵ�˵������ȷ����(�� ��)
A��һ�����淴Ӧ�ﵽ��ƽ��״̬���������Ӧ�ڸ����������ܴﵽ����
B����һ�����淴Ӧ�ﵽƽ��״̬ʱ������Ӧ���ʺ��淴Ӧ������ȣ�������0
C��ƽ��״̬��һ�־�ֹ��״̬����Ϊ��Ӧ����������Ũ���Ѿ����ٸı�
D����ѧ��Ӧ���Ȳ�����ͨ���ı� �����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�����Ȼ�ѧ����ʽ��
��H2��g��+1/2O2��g��=H2O��g�� ��H1��a kJ��mol��1
��2H2��g��+O2��g��=2H2O��g�� ��H2��b kJ��mol��1
��H2��g��+1/2O2��g��=H2O��l�� ��H3��c kJ��mol��1
��2H2��g��+O2��g��=2H2O��l�� ��H4��d kJ��mol��1
���й�ϵʽ����ȷ���ǣ� ��
A��a��c��0 B��b��d��0 C�� 2a��b��0 D��2c��d��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Ϊ̽��п�����ᷴӦ���̵����ʱ仯��ijͬѧ��ʵ��ⶨ�����ǣ���100mlϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų���������ʵ���¼���£���������ѻ���Ϊ��״������
| ʱ��/min | 1 | 2 | 3 | 4 | 5 |
| ���/mL | 50 | 120 | 250 | 306 | 336 |
����˵����ȷ���ǣ�
A��0~1 min��Ӧ���������Ϊ��ʱ��Ӧ��Ũ�����
B��2~3min��Ӧ���������Ϊ��ʱ��Ӧ��Ũ����Խϸߣ��ҷ�Ӧ����ʹ�¶�����
C��3~4 minʱ�����������Ũ�ȱ仯����ʾ��ƽ����Ӧ����Ϊ0.5mol��L-1 ��min-1
D��4~5min��Ӧ���������Ϊ��ʱ��Ӧ�������¶����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ⶨ�к���ʵ��װ����ͼ��

��1����ʵ����ϡ��Һ�У�H��(aq)��OH��(aq)��H2O(1)����H����57.3kJ/mol
������˵����ȷ���ǣ�_____________
A��ϡ�����ϡ NaOH��Һ��Ӧ���к���Ϊ -57.3kJ/mol
B��ϡ������ϡNaOH��Һ��Ӧ���к���Ϊ -57.3kJ/mol
C�� Ũ������ϡNaOH��Һ��Ӧ���к���Ϊ -57.3kJ/mol
D��ϡ������ϡNaOH��Һ��Ӧ����1molˮ���ų�57.3kJ����
������NaOH��Һ����Ba(OH)2��Һ�����ⶨ��������ϡ������Һ�м���100mL0.4mol/L Ba(OH)2��Һ���ų�����5.12kJ����ͨ�����������ʵ���е����к��ȱ仯��ԭ��______________
(2)ȡ50mL0.5mol/LNaOH��Һ��30mL0.5mol/Lϡ�������ʵ�飬������±���ʾ��

���������Ϊ������Һ���ܶȶ���1g/cm3���кͺ����ɵ���Һ������c=4.18J/(g��oC)�����к��� H=__________kJ/mol��С�������1λ��������ʵ��������ֵ��57.3 kJ/mol ��ƫ��,����ƫ���ԭ�������(����ĸ)________________
H=__________kJ/mol��С�������1λ��������ʵ��������ֵ��57.3 kJ/mol ��ƫ��,����ƫ���ԭ�������(����ĸ)________________
A .ʵ��װ�ñ��¸���Ч����
B .����ȡNa0H ��Һ�����ʱ���Ӷ���
C .�ֶ�ΰ�NaOH ��Һ����ʢ�������С�ձ���
D .���¶ȼƲⶨNa0H ��Һ����ʼ�¶Ⱥ�ֱ�ӲⶨH2S04 ��Һ���¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ����
A����������һ�ຬ������ԭ�ӵ�±����
B��1-��ϩ����˳���칹
C��1 mol�������2 molCl2��ȫȡ������CCl4
D�� �Ľṹ�к��о����������ʵĹ����š����ǻ�
�Ľṹ�к��о����������ʵĹ����š����ǻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ����ƽ�VOSO4�е�K2SO4��SiO2���ʳ�ȥ�����յõ�V2O5���������£���ش��������⣺
�� ��������÷����ijɷ��� ��д��ѧʽ��������I������ ��
�� ����ڡ��۵ı仯���̿ɼ�Ϊ����ʽR��ʾVO2+��HA��ʾ�л���ȡ������
R2(SO4)n (ˮ��)+ 2nHA���л��㣩 2RAn���л��㣩 + nH2SO4 (ˮ��)
2RAn���л��㣩 + nH2SO4 (ˮ��)
������ȡʱ��������������ԭ���� ��
����X�Լ�Ϊ ��
�� �ݵ����ӷ���ʽΪ ��
�� 25��ʱ��ȡ����������������õ��������ʺ���ҺpH֮���ϵ���±���
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| ��������% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
����ϱ�����ʵ�������У����м��백ˮ��������Һ�����pHΪ ��
����������Ϊ93.1%ʱ������Fe(OH)3����������Һ��c(Fe3+)< ��
(��֪��25��ʱ��Ksp[Fe(OH)3]=2.6��10-39)
�� �ù��������У�����ѭ�����õ������� �� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com