
| A、某元素由化合态变成游离态,该元素一定被氧化 |
| B、卤素离子(X-)只有还原性而无氧化性 |
| C、失电子难的原子获得电子的能力一定强 |
| D、负一价卤素离子的还原性在同一族中从上至下逐渐增强 |


科目:高中化学 来源: 题型:
 卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近.试回答下列问题:
卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
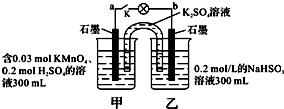
| A、当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1 |
| B、电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a |
| C、电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 |
| D、乙池中的氧化产物为SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电极一定要由两种不同的金属组成 |
| B、电子流出的一极是正极 |
| C、两极均发生氧化还原反应 |
| D、由化学能转化为电能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、锌作正极 |
| B、溶液中SO42-向铜电极方向移动 |
| C、电子由锌片通过导线流向铜 |
| D、负极发生的反应是:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1电池放电过程中,Na+从负极区向正极区迁移 |
| B、图1电池负极区的电极反应为:BH4--8e-+8OH-═BO2-+6H2O |
| C、图2中若电解过程中转移了a mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为6.2a g |
| D、图2阴极反应式为:2NO3-+6H2O+10e-═N2↑+12OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
- 3 |
| A、元素R位于周期表中第VA族 | ||
B、RO
| ||
| C、R-离子的最外层电子数为8 | ||
D、若1molRO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com